Атомная масса – одна из фундаментальных характеристик химического элемента. В Периодической системе Д. И. Менделеева мы можем обнаружить относительную атомную массу, которая измеряется не в г или кг, а в а.е.м, почему же так вышло, что масса измеряется не кг, как принято в СИ?
Значение относительной атомной массы
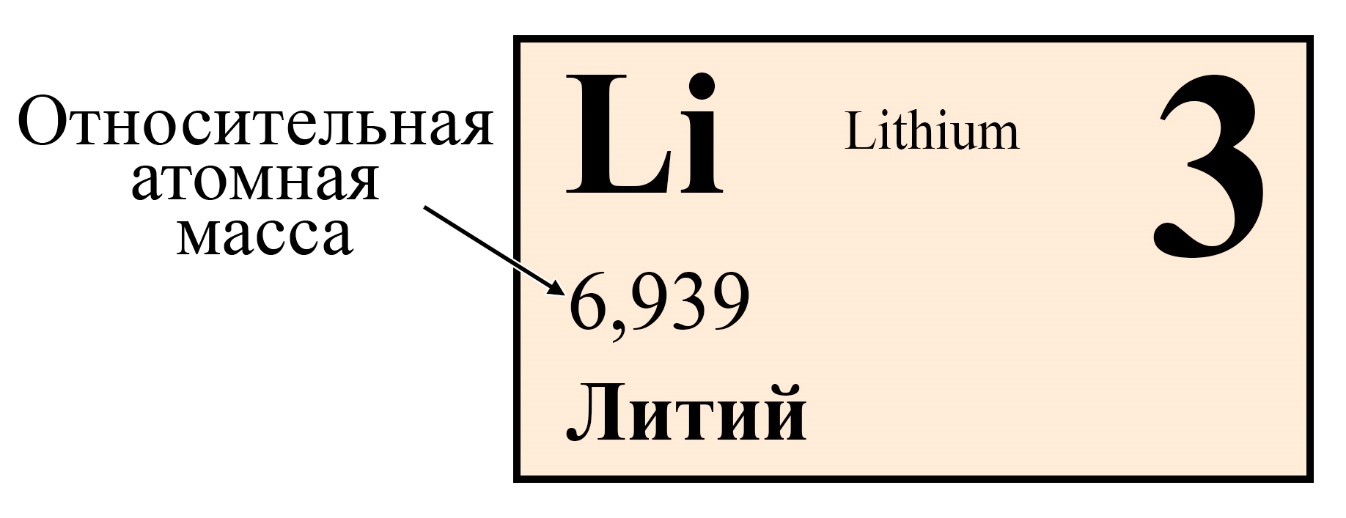
Нетрудно догадаться, что атом – невероятно маленькая частица, обладающая столь же невероятно маленькой массой. Например, масса элемента (то есть усредненная масса изотопов водорода) составляет всего 0,000000000000000000000001674 кг или 1,674∙10−27кг. Пользоваться такими значениями просто неудобно. Как привести данную массу в более удобный вид? Вспомните, когда вы делите 0,000006 на 0,000002, какой результат у вас получается? Ответ: 3. Поэтому химики и физики придумали использовать не абсолютную массу в килограммах, а разделить абсолютные массы на некоторый эталон, что избавит ученых от громоздких вычислений.
Что же взять за эталон?
Первым, в качестве эталона, был предложен водород, как самый легкий элемент. Следует понимать, что на тот момент были известны массы далеко не всех элементов. Но если известна масса водорода, общая масса молекулы и валентность второго элемента, то и его массу подсчитать достаточно легко. Проблема заключалась в том, что большинство элементов не образуют с водородом бинарных соединений, а значит, их массу невозможно измерить.
Вторым за эталон химики взяли 1/16 элемента кислорода (элемент – усредненная совокупность изотопов с массовыми числами 16, 17 и 18), а физики 1/16 изотопа 16O. Поэтому расчеты физиков и химиков расходились и нужно было использовать переходный множитель, что, естественно, совершенно неудобно.
Наконец, только в 1961 г. Международный союз по теоретической и прикладной химии (IUPAC) утвердил в качестве эталона 1/12 массы изотопа углерода 12С. Углерод наиболее удобен тем, что имеет один стабильный изотоп с наибольшей долей на планете (второй стабильный изотоп практически не распространен).
Итак, абсолютная масса изотопа 12С равна 19,93∙10−27 кг. Эталон (углеродная единица) равна 1/12 этого значения, таким образом, можем найти массу углеродной единицы и атомной единицы массы:
1 а. е. м. = 19,93∙10−27 кг : 12 = 1,661∙10−27 кг.
Теперь можно выразить все остальные массы через атомную единицу массы.
Так, абсолютная масса водорода равна 1,674∙10−27кг, разделим эту массу на 1 а. е. м. и получим относительную (относительно 1/12 массы изотопа углерода-12) атомную массу водорода:
Ar (Н) = 1,674∙10−27кг : 1,661∙10−27 кг = 1,0078, где Ar – относительная атомная масса, безразмерная величина (так как при делении сократились 10−27).
На данный момент относительные атомные массы для большинства элементов представлены в Периодической системе Д. И. Менделеева.
Значение относительной атомной массыОтносительная молекулярная масса
Сложное вещество состоит из атомов разных элементов, соединенных часто в разных соотношениях. Эти соотношения показывает нам химическая формула.
Например, молекула воды имеет формулу H2O, после водорода стоит индекс, показывающий, сколько атомов водорода содержит одна молекула воды.
Индекс – множитель, показывающий, сколько атомов одного элемента содержит молекула. Индекс ставится после соответствующего знака элемента и действует только на него.
Таким образом, в одной молекуле Na2SiO3 содержится 2 атома натрия, 1 атом кремния (так как после него не стоит множитель) и 3 атома кислорода.
Если индекс стоит после скобки, то он действует на все элементы, находящиеся внутри этих скобок. Например, в одной молекуле Ca(OH)2 1 атом кальция, 2 атома кислорода и 2 атома водорода.
Если на один и тот же элемент действуют два индекса одновременно, то их следует перемножать. Например, в одной молекуле Al2(SO4)3 содержится 2 атома алюминия, 3 атома серы и 12 атомов кислорода.
Когда мы разобрались в индексах, можно приступать к подсчетам молекулярных масс.
Mr – относительная молекулярная масса, складывается из относительных атомных масс входящих в состав молекулы атомов с учетом их количества (то есть индексов).
Найдем относительную молекулярную массу для хлорида алюминия.
Проанализируем состав AlCl3: одна молекула содержит 1 атом алюминия и 3 атома хлора.
1 атом алюминия имеет Ar = 27.
1 атом хлора имеет Ar = 35,5 (это один из немногих атомов, чью относительную атомную массу мы не округляем до целых). А три атома хлора имеют относительную атомную массу 3 ∙ 35,5 = 106,5.
Таким образом, Mr (AlCl3) = 27 + 106,5 = 133,5.
Массовая доля элемента в сложном веществе
Массовая доля элемента в сложном веществе – это отношение Ar выбранного элемента с учетом его количества к Mr всей молекулы. Не имеет размерности, может быть выражена в долях единицы или в %.
Находят массовую долю элемента по формуле:
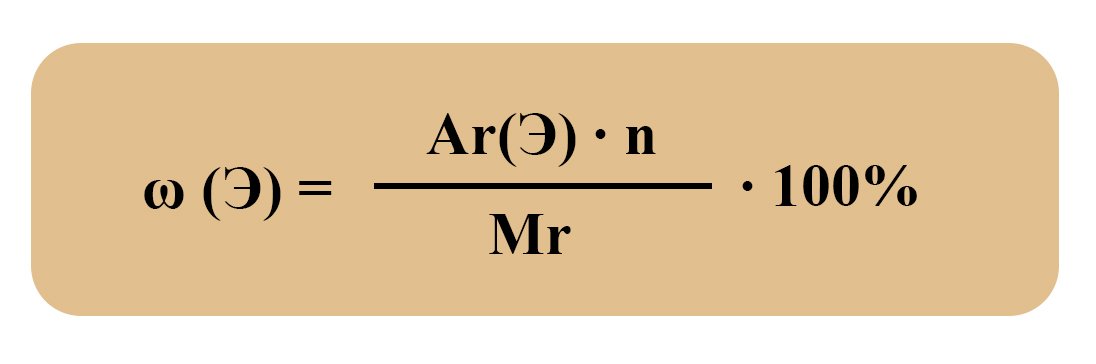
ω (Э) – массовая доля элемента в молекуле вещества. Произносится как «омега»;
Ar – относительная атомная масса;
n – количество атомов данного элемента в одной молекуле вещества;
Mr – относительная молекулярная масса одной молекулы.
Для примера найдем массовую долю серы в серной кислоте (H2SO4):
ω(S) = 32 ∙ 1 / 1 ∙ 2 + 32 + 16 ∙ 4 = 32 / 98 = 0,3265 (в долях), если мы хотим выразить ответ в процентах, умножаем на 100%.
ω(S) = 0,3265 ∙ 100% = 32,65%.

 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна  Крылова Елизавета Владимировна
Крылова Елизавета Владимировна 
 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна