- Ковалентные связи
- Полярность связи
- Сравнение ковалентной полярной и неполярной связи
- Ионная связь
- Сравнение ионных и ковалентных связей
- Металлические связи
- Таб. – Типы связей для ОГЭ по химии
Урок №6. Подготовка к ОГЭ по химии
Вопрос о природе химической связи.
Уже давно исследователи обратили внимание на тот факт, что наиболее устойчивые химические элементы (благородные или инертные газы) содержат на внешнем уровне восемь электронов. Исключение – гелий, у него два электрона на внешней оболочке, однако он тоже благородный, так как он имеет всего одну оболочку, его последняя оболочка является одновременно и первой, а на ней максимум может находиться два электрона. Таким образом, последняя оболочка гелия является и первой, на которой располагается максимум электронов.
Наблюдение о восьмиэлектронной оболочке послужило предпосылкой возникновения октетной теории или теории электронных пар. Исследователи предположили, что раз восьмиэлектронная оболочка является наиболее устойчивой, а атомы стремятся к устойчивости, то они могут добиться её путем получения восьмиэлектронного внешнего слоя.
Появление октетной теории позволило разделить химическую связь на два основных типа: ковалентную и ионную.
У элементов есть два пути достижения восьмиэлектронной оболочки:
- Образование ковалентных связей за счет объединения электронов в общие пары с атомами других элементов.
- Образование ионных связей за счет перехода электронов с оболочки одного элемента на оболочку другого элемента.
От чего зависит, какая связь будет образовываться? От разницы в электроотрицательности элементов, атомы которых вступают в химическую связь.
Вспомним, что элементы, находящиеся в Периодической системе, слева обладают низкими значениями электроотрицательности, а элементы, находящиеся в ПС справа, имеют большие значения электроотрицательности. Таким образом, чем ближе друг к другу в ПС стоят элементы, тем разница их электроотрицательности меньше; чем дальше в ПС стоят друг от друга элементы, тем больше разница в их электроотрицательности.
Для сравнения электроотрицательности между неметаллами можно пользоваться следующей последовательностью:
Ковалентные связи
Рассмотрим образование связей между атомами элементов с одинаковыми или близкими значениями электроотрицательности.
Изобразим строение атома фтора:
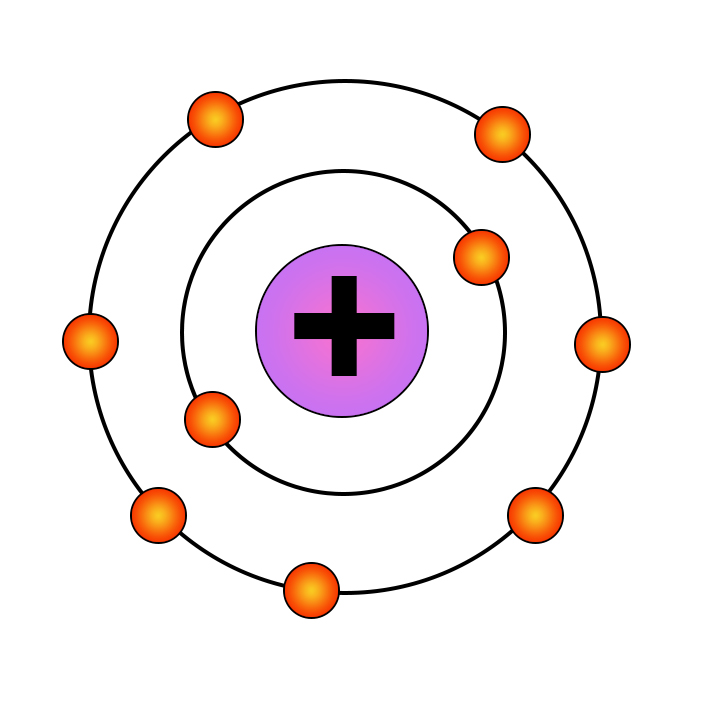
Он имеет семь электронов на внешнем слое, ему до образования октета необходимо получить еще один электрон. Допустим, что недалеко друг от друга находятся два таких атома фтора, чем они ближе друг к другу, тем сильнее электрон первого фтора притягивается к положительно заряженному ядру второго фтора, но одновременно растет и сила отталкивания одинаково заряженных частиц двух атомов. На определенном расстоянии между двумя атомами фтора силы притяжения и силы отталкивания уравновешиваются, это расстояние настолько мало, что электронные оболочки двух атомов фтора перекрываются, таким образом, в определенный момент времени оба электрона находятся в поле притяжения обоих атомов.
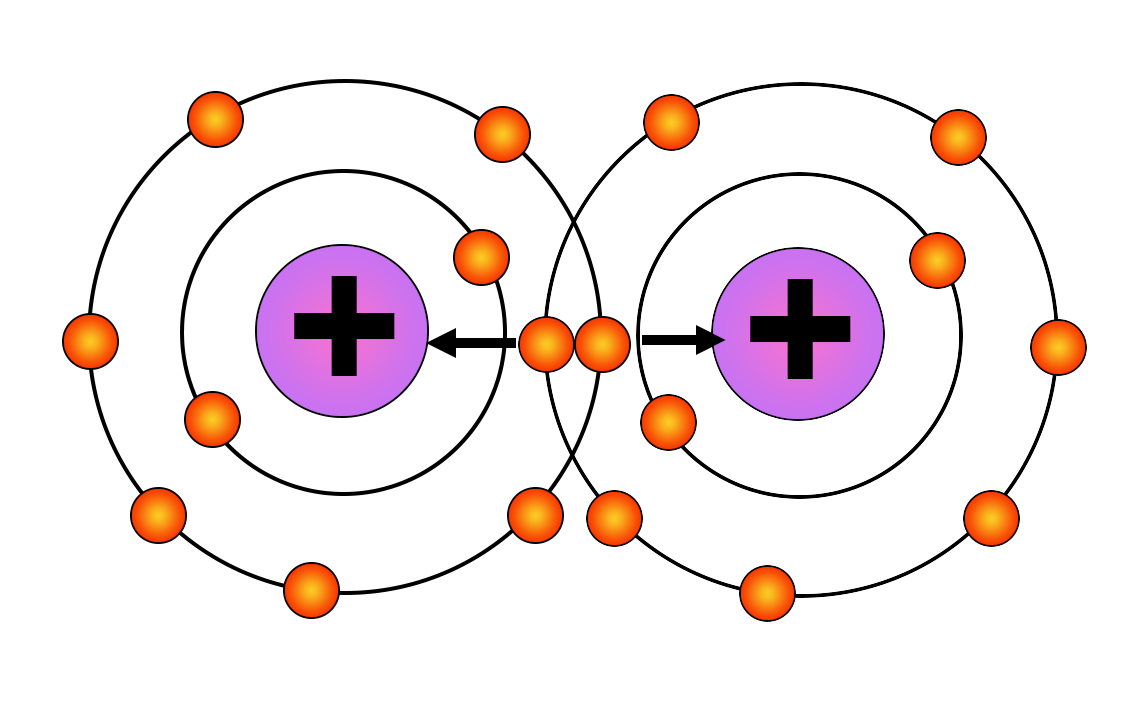
В термине «ковалентный» приставка «ко» - обозначает «совместный». Имеется в виду объединение электронов в общее пользование. Объединенные в пару электроны одновременно принадлежат обоим фторам, таким образом, становится удовлетворенной их потребность в 8 электронах на внешнем электронном слое.
Данную схему образования связи можно изобразить иначе:
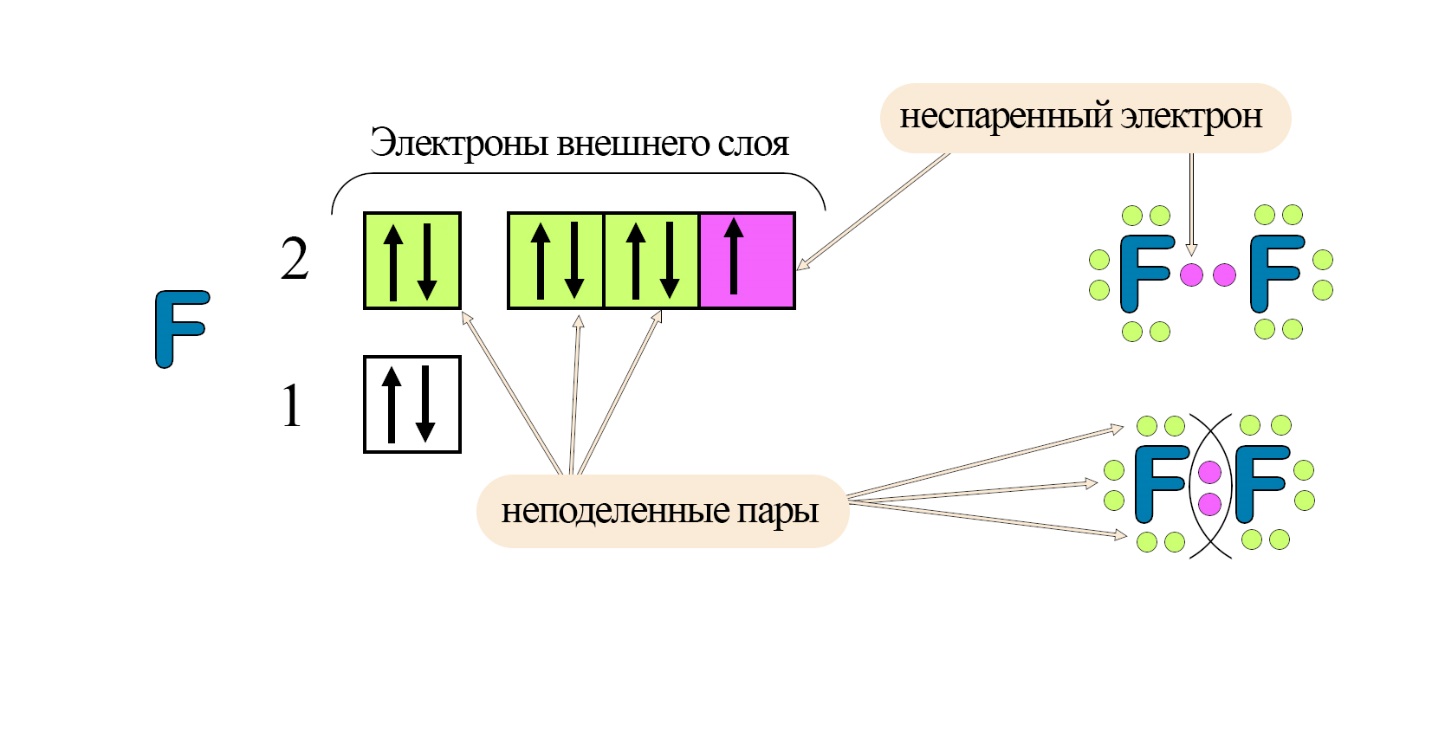
На внешнем слое атома фтора имеются как неподеленные электронные пары, так и неспаренный электрон (он и будет выступать в данном случае валентным электроном). Электронные пары указывают в виде точек по 2 по разные стороны значка элемента, неспаренные электроны располагают у разных атомов таким образом, чтобы их было легко объединить. Напомним, что при появлении одной общей электронной пары у каждого участника химической связи возникает валентность «I», однако, так как связь неполярная (состоящая из одинаковых по значению электроотрицательности атомов), степень окисления будет равна «0».
Полярность связи
- Полярность связи зависит от электроотрицательности элементов, между которыми образуется связь.
- Если связь образуется между атомами элементов с одинаковой электроотрицательностью, то электроны с одинаковой силой притягиваются к обоим ядрам и располагаются на одинаковом расстоянии между ядрами обоих элементов.
Это можно сравнить с перетягиванием каната между двумя детьми с абсолютно одинаковой силой: никто из них не сможет перетянуть канат на себя. Так же и в примере с двумя атомами фтора: обладая одинаковой электроотрицательностью оба атома фтора тянут общую электронную пару с одинаковой силой, она остается ровно посередине между ними.
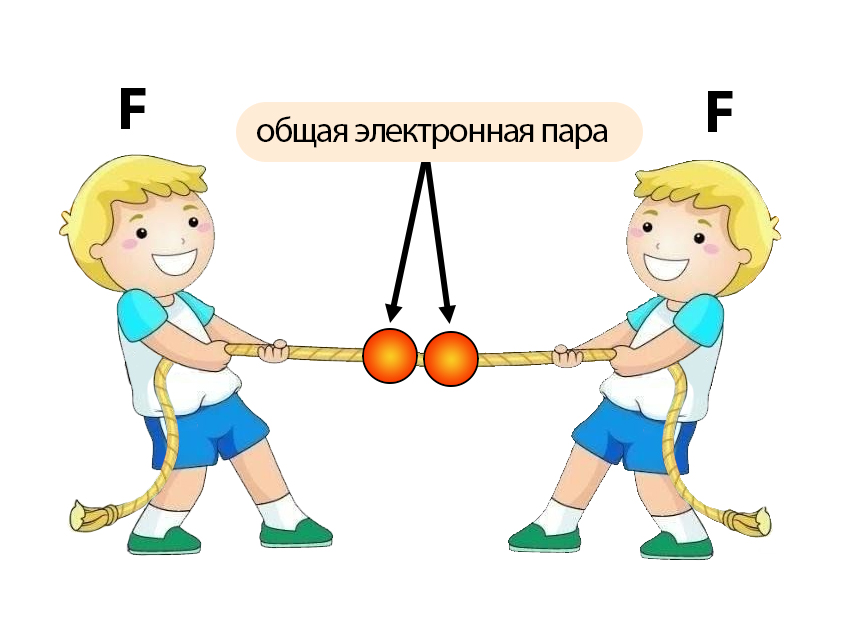
А теперь представим, что канат перетягивают ребята, имеющие разную силу (ведь в большинстве случаев так и бывает).

Тот, кто имеет большую силу, перетянет на себя канат. Аналогично с образованием ковалентной пары: атом элемента с большей электроотрицательностью перетянет к себе поближе общую электронную пару. Особенность ковалентных связей заключается в том, что разница в электроотрицательности образующих связь элементов не очень велика, поэтому один атом не сможет полностью перетянуть электронную пару на себя, а лишь немного её перетянет.
Рассмотрим полярность связи на примере взаимодействия атома фтора и йода. У обоих до завершения внешней электронной оболочки недостает одного электрона, поэтому образуется одна ковалентная связь.
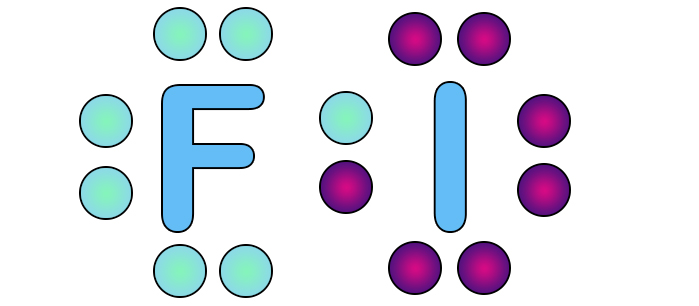
Фтор обладает большим значением электроотрицательности, он притягивает к себе общую электронную пару.
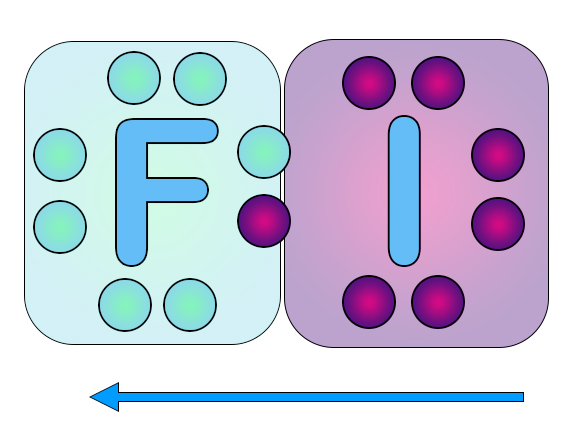
Электроны остаются общими, но принадлежат фтору больше, чем йоду.
Так как электроны несут знак «минус», фтор, притянувший к себе электроны, становится частично отрицательным, а йод испытывает недостаток электронной плотности, так как общая пара немного удалена от него, на нем формируется частично положительный заряд.
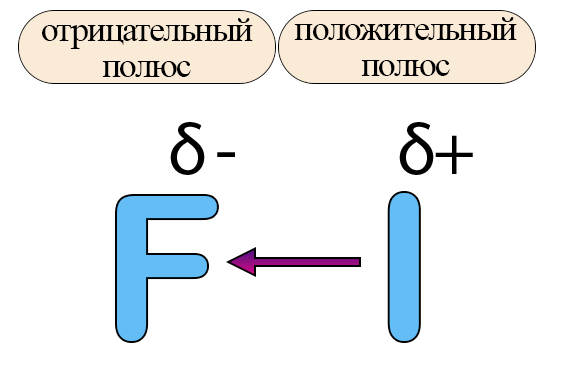
Таким образом, в следствие перетягивания общей электронной пары в сторону одного атома, формируются полюса. Напомним, что полярность – это свойство, обусловленное появлением структур с совершенно противоположными свойствами (как полюса Земли находятся на противоположных её сторонах). Получившиеся частичные заряды для упрощения подсчетов превращают в целые заряды и считают за степень окисления, хоть и данное понятие ближе к ионным связям.
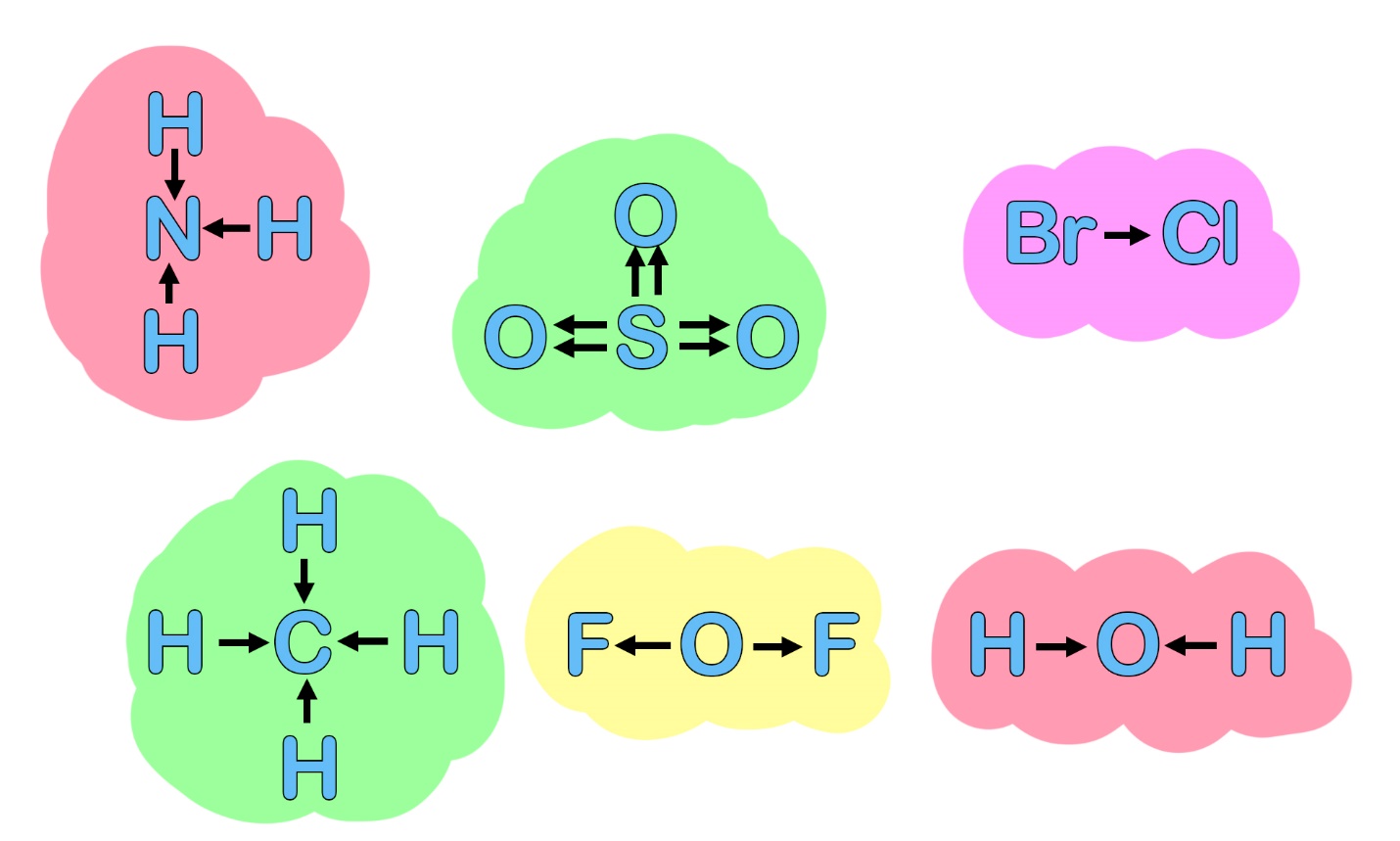
Так как чаще всего положительно заряженная частица пишется первой, полученная молекула будет иметь вид I+F−. В веществах, имеющих связь между разными неметаллами, возникает полярность. Смещение общих электронных пар можно показать стрелками. Атом, к которому направлена стрелка, будет приобретать отрицательный заряд, атом, от которого идет стрелка – положительный заряд.
Сравнение ковалентной полярной и неполярной связи
|
Характеристики |
Ковалентная полярная связь |
Ковалентная неполярная связь |
|
Механизм образования |
Объединение электронов в общие пары |
Объединение электронов в общие пары |
|
Смещение электронной плотности |
В сторону более электроотрицательного элемента |
Не происходит |
|
Между атомами каких элементов |
Между атомами разных неметаллов |
Между атомами одинаковых неметаллов |
|
Примеры |
HCl |
H2 |
Ионная связь
Мы видели, что когда связь образуется между атомами элементов с отличающейся электроотрицательностью, тот атом, что имеет бОльшую электроотрицательность, притягивает к себе общую электронную пару.
А теперь представьте, что связь образуется между атомом с очень большой электроотрицательностью и атомом с очень маленькой электроотрицательностью. В таком случае более электроотрицательный элемент не просто притянет пару, а полностью заберет чужой электрон.
Через образование ионной связи атомы также реализуют образование восьмиэлектронной оболочки. Механизм отличается от механизма образования ковалентной связи тем, что в ионной происходит полная передача электронов.
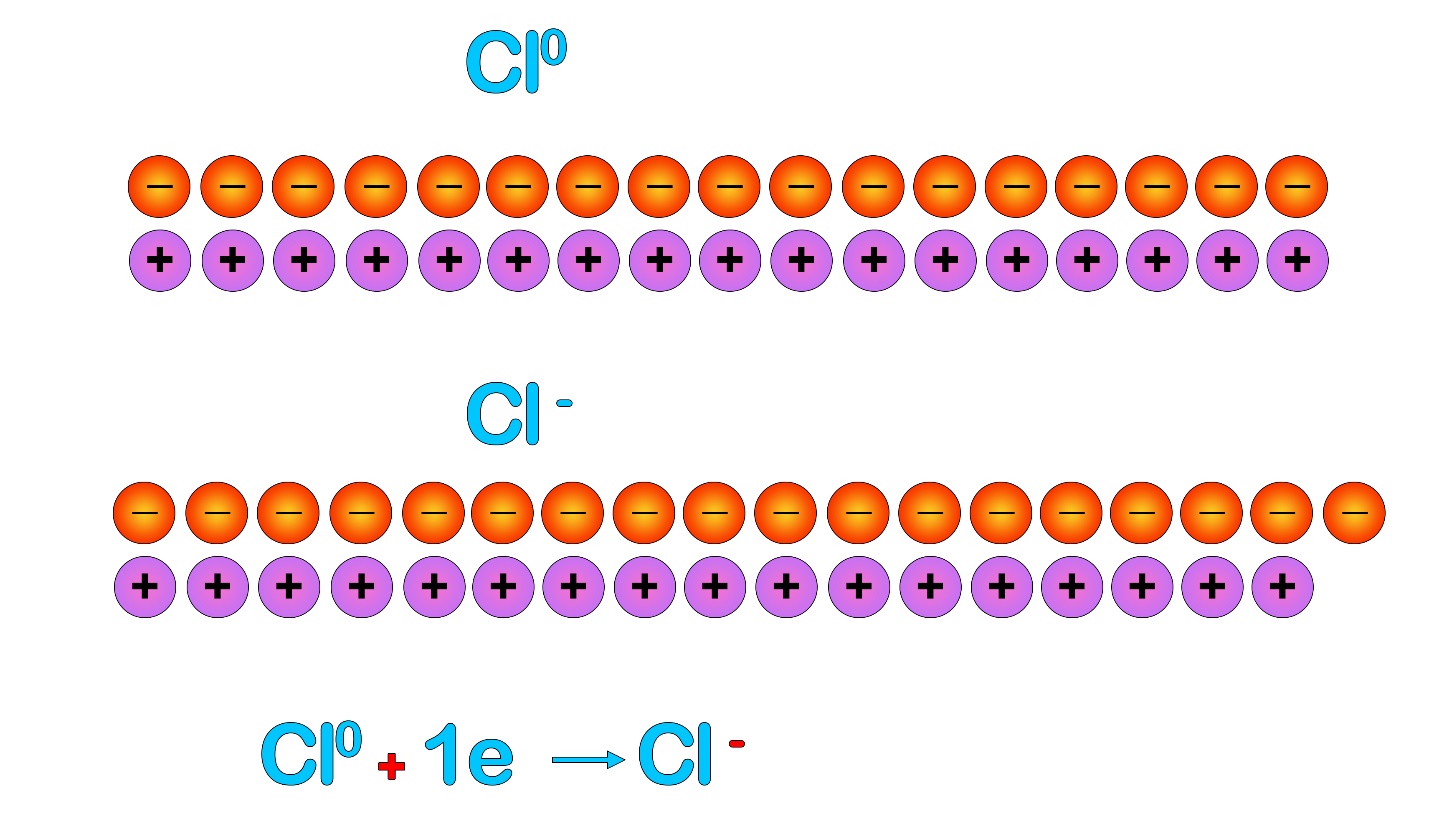
Рассмотрим на примере образования связи в хлориде натрия. Может показаться, что хлор ближе к восьмиэлектронной оболочке, чем натрий, но это не так: как хлору достаточно совершить одно «действие» - принять электрон, так и натрию нужно совершить одно «действие» - отдать электрон. В таком случае вместе с электроном внешнего уровня пропадет и сам уровень и предвнешний, восьмиэлектронный, станет внешним.
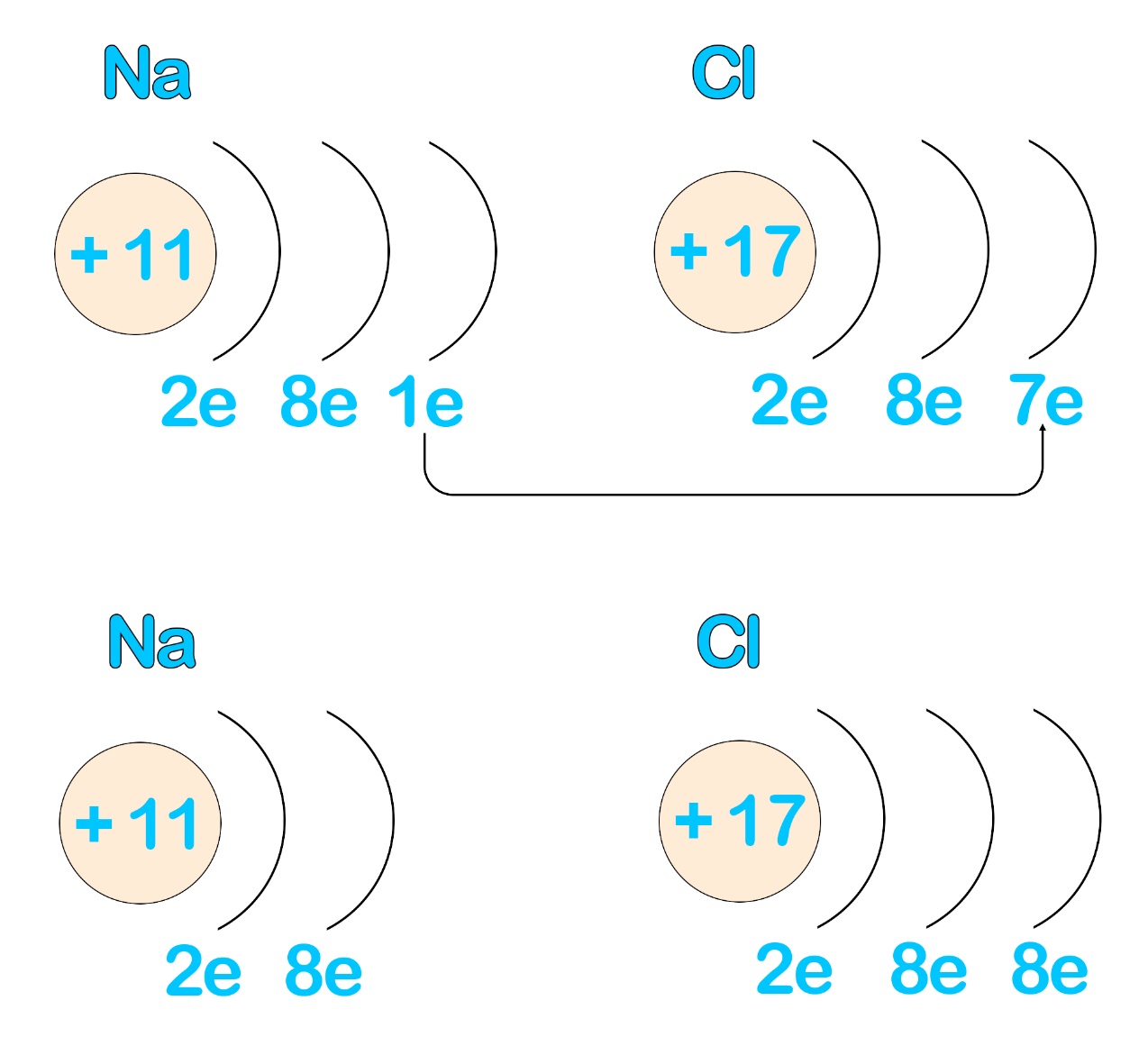
Таким образом, между атомами возникает своего рода «симбиоз» - ионную связь образуют те атомы, которым нужно совершать противоположные действия для формирования идеальной оболочки. Обычно такие пары образуют металл с неметаллом. Металлы имеют небольшое количество электронов на внешнем уровне и сравнительно большой радиус, они легко отдают внешние электроны. Неметаллы имеют большее количество электронов и меньший радиус, они сильнее удерживают свои внешние электроны и сильнее притягивают чужие электроны.
Приобретая конфигурацию благородного газа, металлы и неметаллы приобретают заодно заряды (степени окисления).
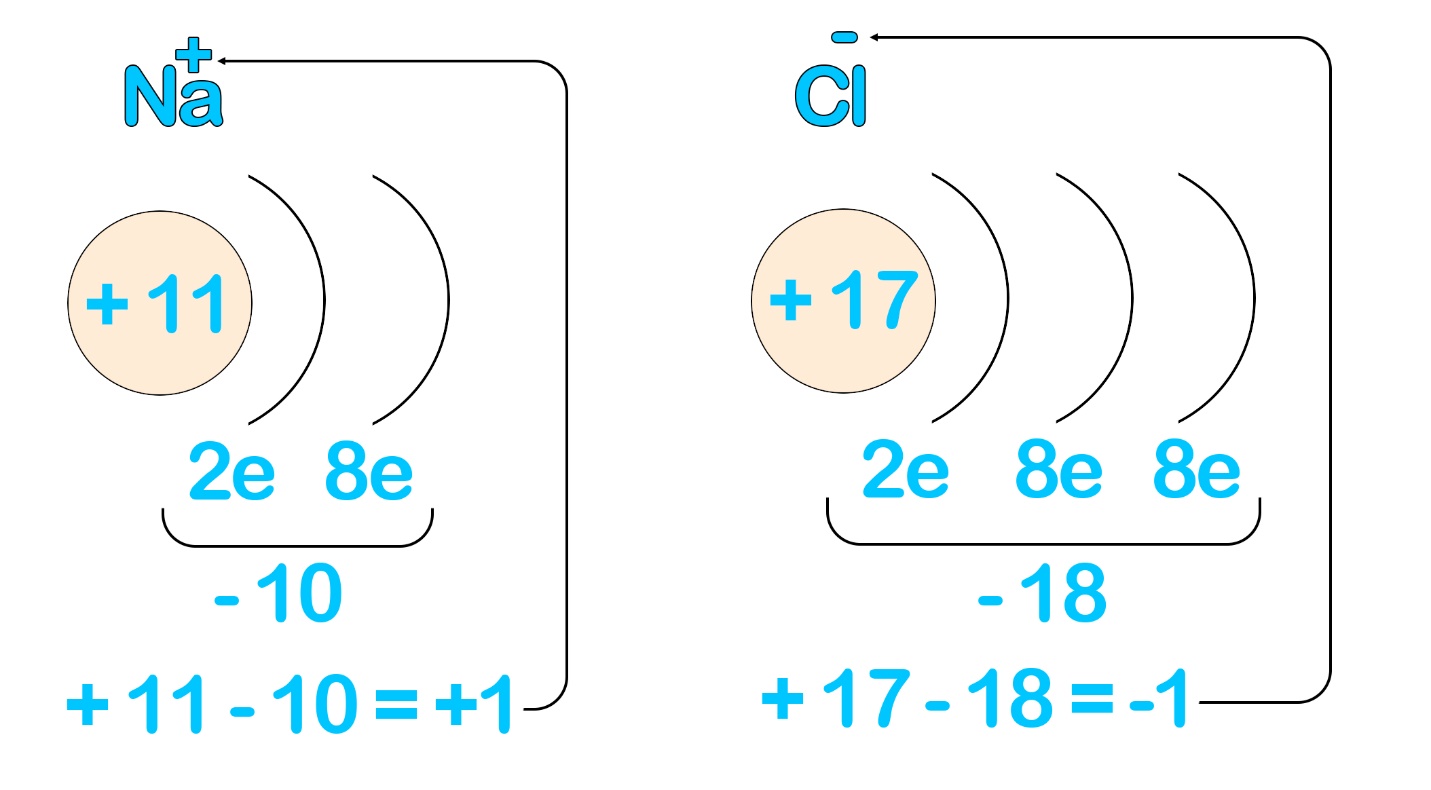
Количество протонов в ядрах не меняется, а вот количество электронов поменялось, это означает, что общее количество положительных и отрицательных зарядов теперь не равно и частица перестала быть электронейтральной. У натрия положительных зарядов стало на один больше, чем отрицательных, поэтому у него появился заряд «+1» или просто «+», он стал положительно заряженным ионом – катионом. У хлора – ровно наоборот, он стал отрицательно заряженным ионом – анионом.
Из-за сформировавшихся противоположных зарядов катион натрия и анион хлора притягиваются друг к другу, и это и служит причиной образования ионной связи.
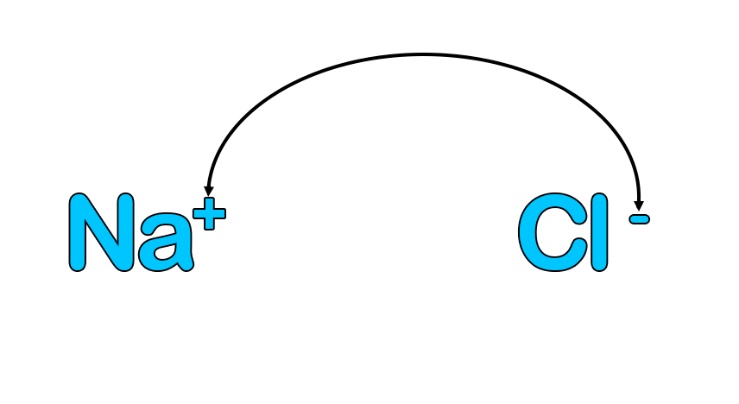
Почему тот, кто отдает электрон, становится положительным?
Такой вопрос возникает у школьников при написании электронного баланса. Если схема с передачей электронов и подсчет протонов и электронов не помог и этот момент все равно не ясен, попробуйте подойти к этому с другой стороны.
Мы помним, что в математике один плюс и один минус «нейтрализуют» друг друга, то есть сокращаются. Каждая пара плюсов и минусов дает нам в результате ноль. В атоме натрия количество положительных и отрицательных зарядов совпадает, поэтому атом имеет степень окисления «0» - он электронейтрален. Если натрий отдаст (- е) один электрон, то у него уменьшится общее количество отрицательных зарядов:
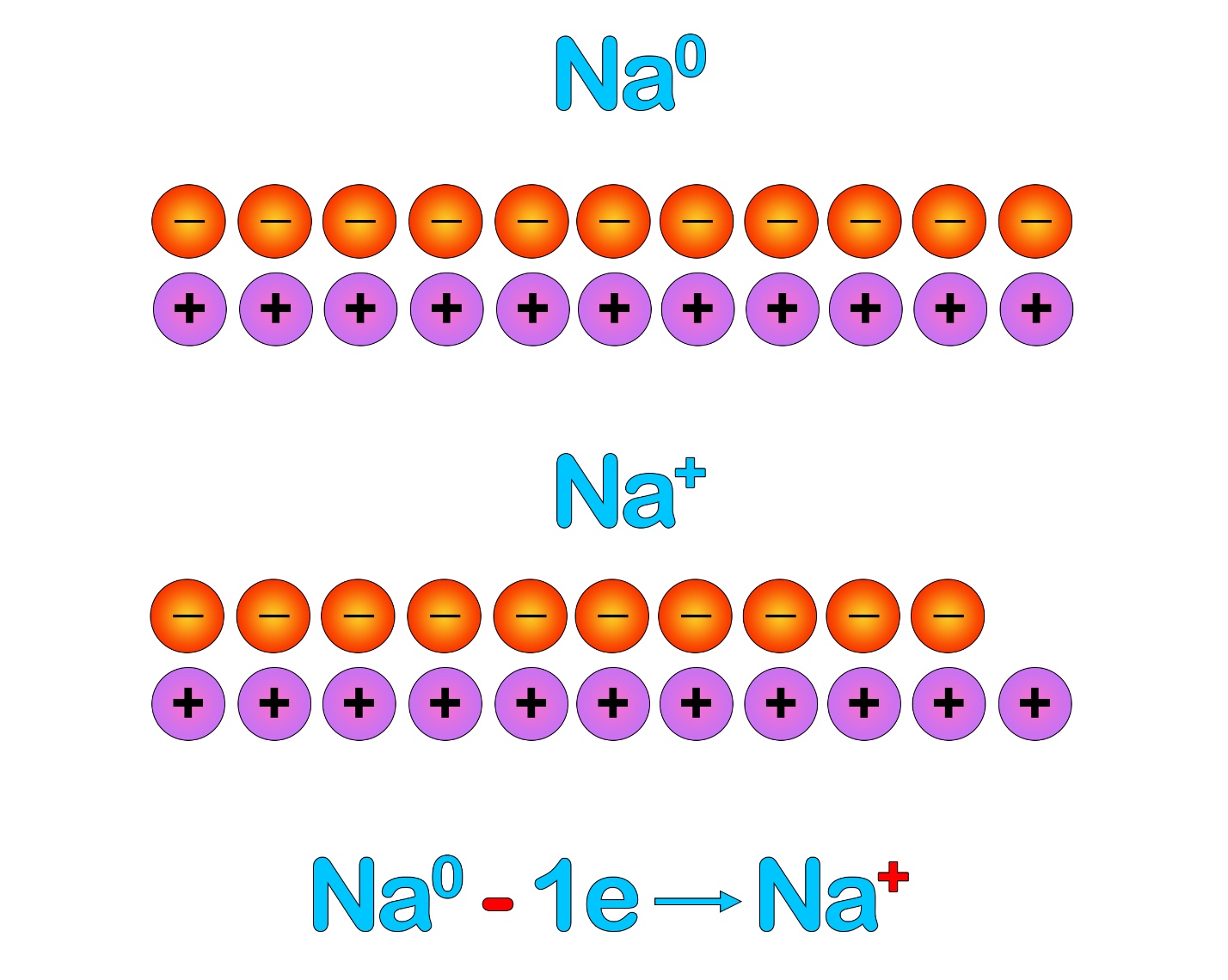
«Плюсов» станет на один больше, чем минусов, поэтому натрий станет положительно заряженным.
Аналогична ситуация с хлором:
Сравнение ионных и ковалентных связей
|
Ковалентные связи |
Ионные связи |
|
Образуются между атомами элементов с близкими или одинаковыми значениями электроотрицательности |
Образуются между атомами элементов с сильно отличающимися значениями электроотрицательности |
|
Образуется за счет объединения неспаренных электронов разных атомов в общие электронные пары, принадлежащие одновременно обоим атомам |
Образуется за счет притяжения заряженных частиц (ионов). Заряды появляются в следствие передачи электронов от атома одного элемента другому |
Можно сказать, что ионные связи образуются между металлами и неметаллами, но есть несколько исключений. На ОГЭ нужно знать, что соли аммония (то есть то, что содержит катион аммония NH4+) хоть и состоят из неметаллов, но тоже содержат ионную связь за счет притяжения катиона аммония и аниона кислоты. О природе образования ионной связи в данном случае мы расскажем в аналогичной теме подготовки к ЕГЭ по химии.
Металлические связи
Металлы настолько стремятся отдать свои электроны для приобретения конфигурации благородного газа, что могут это сделать «в никуда», но при этом они приобретают положительный заряд, что притягивает электрон. Между ионами металла происходит постоянное движение электронов, что формирует металлическую связь.
На рисунке ниже стрелками показано движение электронов между ионами натрия.
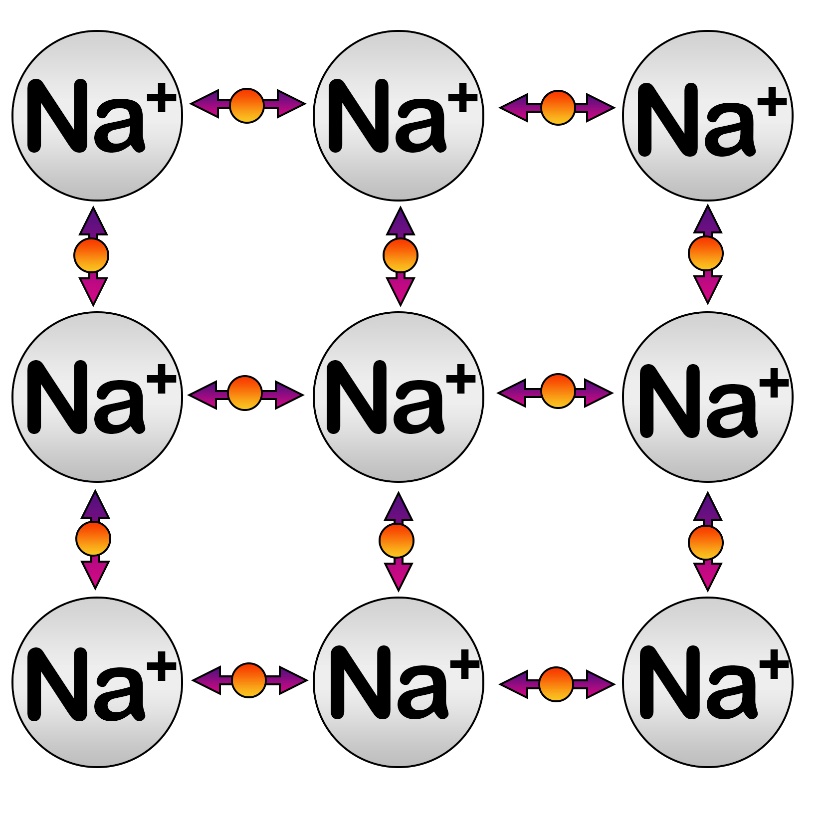
Это можно сравнить с игрой в бадминтон: каждый натрий «отшвыривает» электрон, мешающий ему стать идеальным. Но электрон тянется к любому соседнему катиону натрия. Это притяжение и отшвыривание происходит настолько быстро и часто, что формируется химическая связь.

Если у вас очень мало времени на подготовку к ОГЭ
К сожалению, бывают такие случаи, что к нам приходят ученики, которым нужно очень быстро, буквально за месяц, подготовиться к сдаче ОГЭ по химии. В таком случае, им приходится давать сокращенные материалы.
В таком случае нужно выучить:
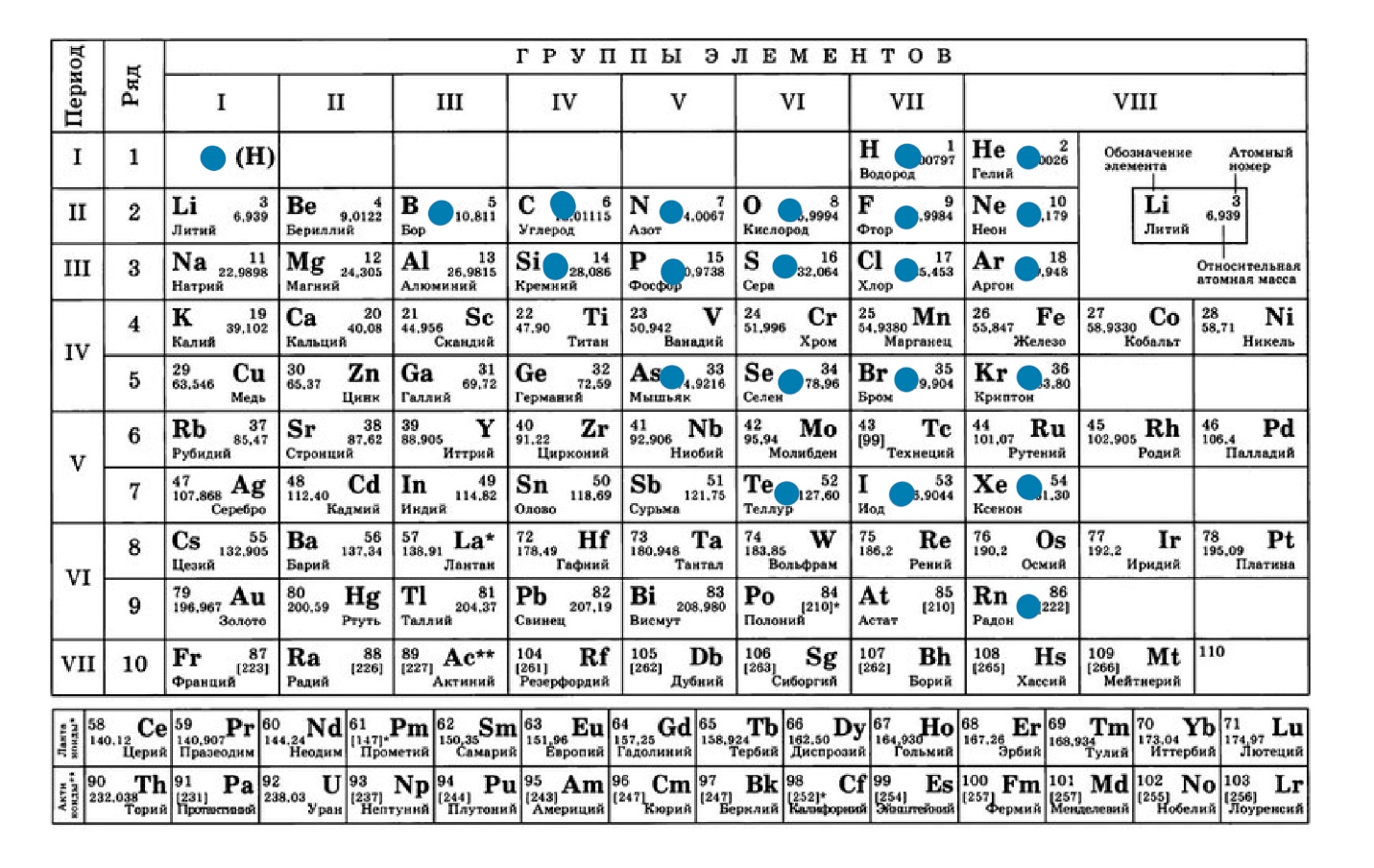
- Расположение металлов и неметаллов в ПС. На данной таблице отображены неметаллы:
- Таблицу с короткими характеристиками связей:
Таб. – Типы связей для ОГЭ по химии
|
Типы связей |
Ковалентные неполярные связи |
Ковалентные полярные связи |
Ионные связи |
Металлические связи |
|
Между какими элементами образуется |
Между атомами одного и того же неметалла |
Между атомами разных неметаллов |
Между атомами металлов и неметаллов, а также в солях аммония |
В металлах |
|
Примеры |
Cl2, H2, P4, S8 |
HCl, H2SO4, NH3 |
NaCl, Al2O3, NH4Cl |
Ca, Fe, Cu, Na |

 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна  Крылова Елизавета Владимировна
Крылова Елизавета Владимировна 

 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна