Данные понятия стоит изучить для выполнения типовых тестовых заданий №1 и №3, так же это поможет понять тему «Ковалентные связи», которая часто встречается в задании №4 ЕГЭ по химии.
Валентность – это количество связей, которые способен образовать химический элемент за счёт объединения своих неспаренных электронов с неспаренными электронами других элементов.
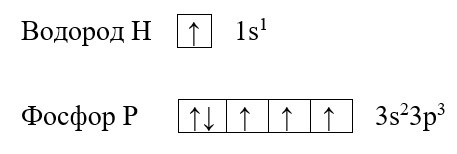
Для наилучшего понимания этой темы необходимо изобразить структуру атомов нескольких элементов, например, фосфора и водорода:
Возбужденное состояние атома. Валентность.
 Валентность водорода и фосфора
Валентность водорода и фосфора
Обе предложенные схемы описывают образование химической связи между фосфором и водородом. Раз фосфору необходимо приобрести пару для целых трёх своих электронов. А водород может «предложить» только один электрон, то к одному атому фосфора может присоединиться три атома водорода. На рисунке справа знаком «*» обозначены неспаренные электроны фосфора, а точками – неспаренные электроны водорода, между которыми и образуется связь (обозначена красным цветом). Связь, при которой происходит объединение электронов в общие пары называется ковалентной, эта связь достаточно прочная и является одной из самых распространённых связей.
Водород содержит один неспаренный электрон, до завершения внешней электронной оболочки ему не хватает всего одного электрона (так как водород имеет только один энергетический уровень, его первый уровень одновременно является и последним, на первом уровне может поместиться только два электрона). Фосфору для полной внешней электронной оболочки не хватает трех электронов, на схеме выше видно, что у него три неспаренных электрона. В таких случаях элементы могут вступать в своеобразных химический «симбиоз»: объединять электроны в общее пользование. При этом неспаренные электроны будут принадлежать одновременно обоим элементам. Данный процесс можно изобразить следующим образом:
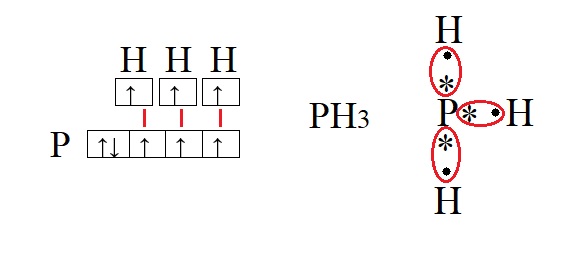
В качестве примеров образования таких связей приведём еще несколько молекул:
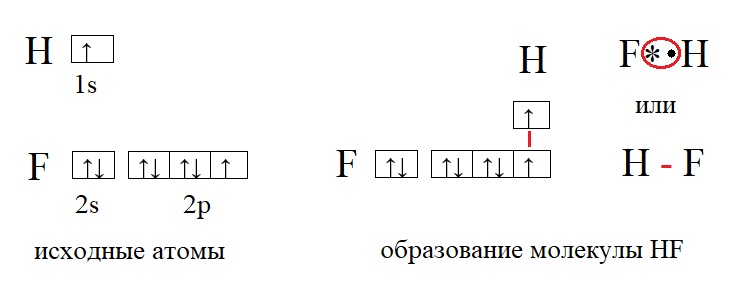
У фтора и у водорода по одному неспаренному электрону, поэтому их валентность равна единице. Валентность записывают римскими цифрами, она не имеет заряда, а отражает лишь количество связей, которые способен образовать элемент. Так валентность фтора I, валентность водорода тоже I. Между такими элементами образуется одна связь. Но есть элементы, способные образовывать гораздо большее количество связей, а значит иметь большую валентность, например:
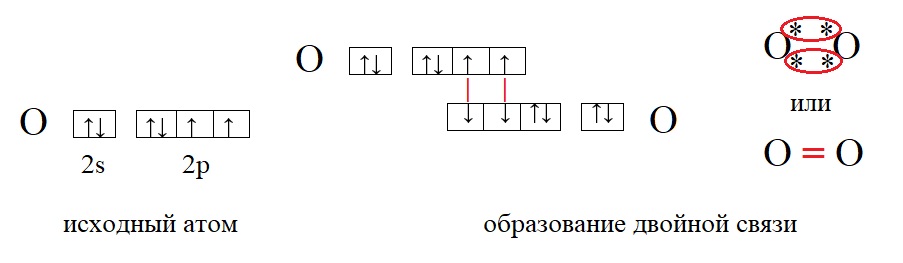
У кислорода в данном примере валентность равна II, это значит, что каждый атом кислорода способен образовать две связи.
Возбуждённое состояние атома.
Углерод – один из самых важных элементов на планете Земля, без него невозможна жизнь. Каждая молекула органического вещества содержит четырехвалентный углерод. В чем же подвох? Дело в том, что в основном своём состоянии углерод содержит лишь два неспаренных электрона и способен проявлять валентность II, а не IV, как в органических молекулах или углекислом газе. Однако существует процесс «распаривания» электронов – перенос одного из электронов пары на другую орбиталь, при это валентность повышается:
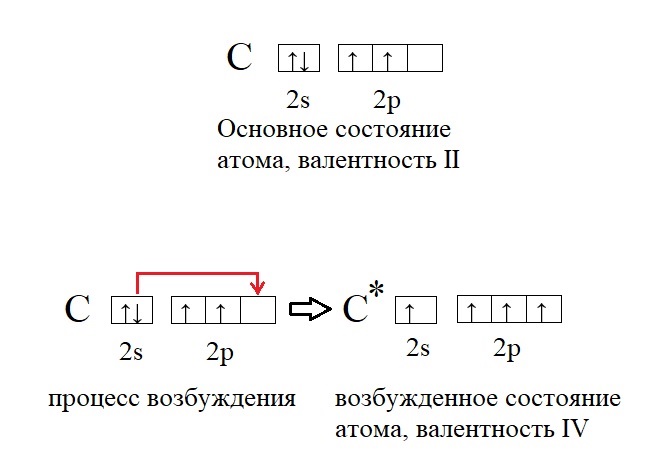
Не только углерод, но и многие другие элементы способны переходить в возбужденное состояние. У большинства элементов, точнее у тех элементов, что имеют три и более энергетических уровня (то есть находятся ниже второго периода в ПС) на внешнем уровне есть свободная d-орбиталь, на ней в основном состоянии нет электронов, но она может принимать их при возбуждении:
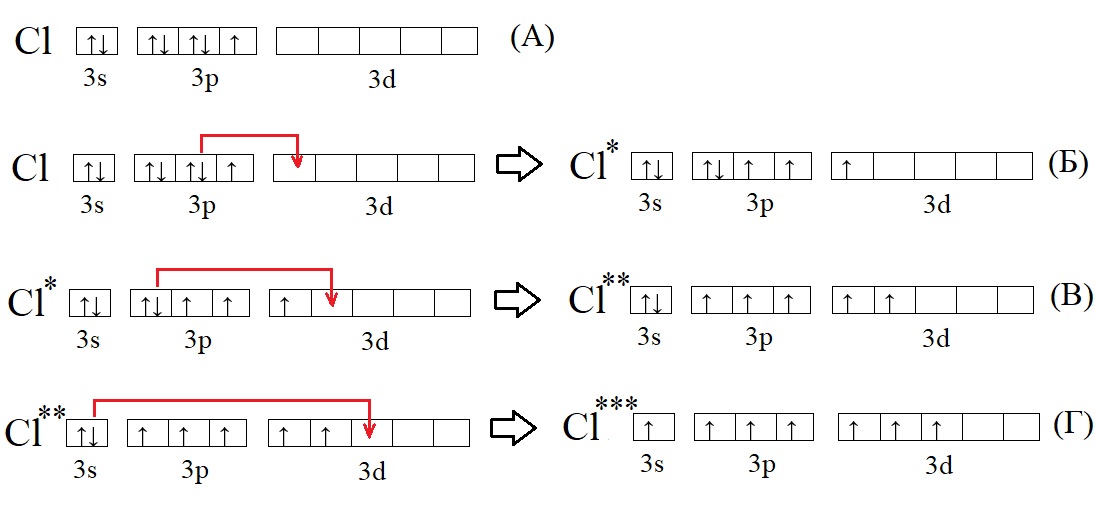
А – основное состояние атома хлора, есть один неспаренный электрон, такая структура соответствует валентности I. Первую валентность хлор имеет в соединениях HCl и HClO.
Б – первое возбужденное состояние хлора, есть три неспаренных электрона, это соответствует валентности III (HClO2).
В – второе возбужденное состояние, пять неспаренных электронов определяют способность проявлять в таком состоянии валентность V (HClO3).
Г – третье валентное состояние, есть семь неспаренных электронов, в таком состоянии хлор может образовывать семь ковалентных связей (HClO4)
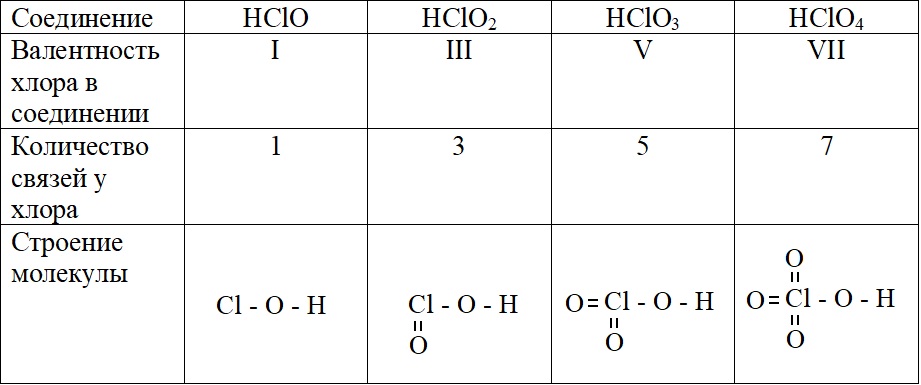
Высшая валентность определяется номером группы, в которой стоит элемент, но есть исключения: азот, кислород и фтор. Для этих элементов не характерна высшая валентность, соответствующая номеру группы. Это объясняется тем, что у этих элементов электроны располагаются на двух энергетических уровнях, а свободная d-орбиталь, которая может принять электроны при их распаривании есть у элементов, имеющих три и более энергетических уровня.
Сравним кислород с серой, у которой есть свободная d-орбиталь:
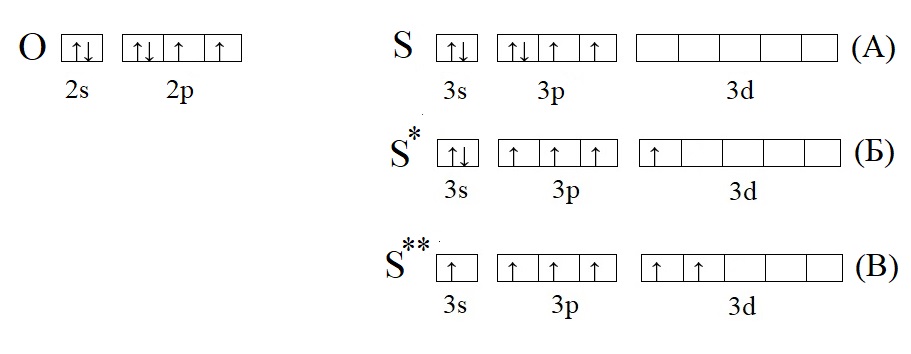
Кислород из-за отсутствия свободной орбитали не способен проявлять валентность выше II, тогда как у серы есть три валентных состояния: основное, соответствует валентности II (H2S); первое возбужденное, соответствует валентности IV (H2SO3 и SO2); второе возбужденное состояние, соответствует валентности VI (H2SO4, SO3).
Решение задания №3 ЕГЭ по химии
Пример 1.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. |
Определите, атомы каких из указанных элементов в возбужденном состоянии имеют конфигурацию внешнего энергетического уровня ns1np3nd1.
Решение: Электроны могут перераспределяться только внутри одного уровня, общая сумма электронов внешнего уровня, в приведенной в задании формуле, равно пяти, следовательно элемент относится к VА-группе. Это фосфор, азот и мышьяк. Азот не имеет свободную d-орбиталь (см. выше), поэтому выпадает из ответа.
Ответ: 15

 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна  Крылова Елизавета Владимировна
Крылова Елизавета Владимировна 
 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна