Элементы побочной подгруппы еще называют d-элементами или переходными металлами. Они отличаются тем, что их валентные электроны расположены не только на s-подуровне внешнего энергетического слоя, но и на d-подуровне предвнешнего слоя. Валентными электронами называют те, что способны участвовать в образовании химической связи.
Что бы построить модель атома такого элемента, нам необходимо знать одно важное отличие этих элементов от элементов А-подгрупп: если у элементов главных (А) подгрупп количество электронов на внешнем уровне определяется по номеру группы (например, у лития один электрон на внешнем слое, у бериллия – два, у бора – три и так далее), то у элементов побочных подгрупп это количество не зависит от номера группы.
Для определения количества электронов на внешнем уровне, легче всего просто запомнить несколько распространённых примеров (они выделены красным):
Количество электронов на внешнем уровне | Примеры элементов |
|---|---|
1 | Cu, Ag, Au, Nb, Cr, Mo, Ru, Rh, Pt, Ds |
2 | Все остальные элементы B-подгрупп, кроме палладия. |
Остальные правила работают как с элементами А-подгрупп, так и с элементами Б-подгрупп. Например, заряд ядра определяется по порядковому номеру элемента, количество энергетических уровней по расположению в определенном периоде.
Рассмотрим конфигурацию нескольких элементов побочных подгрупп:
Построение структурно-электронной формулы элементов B-подгрупп
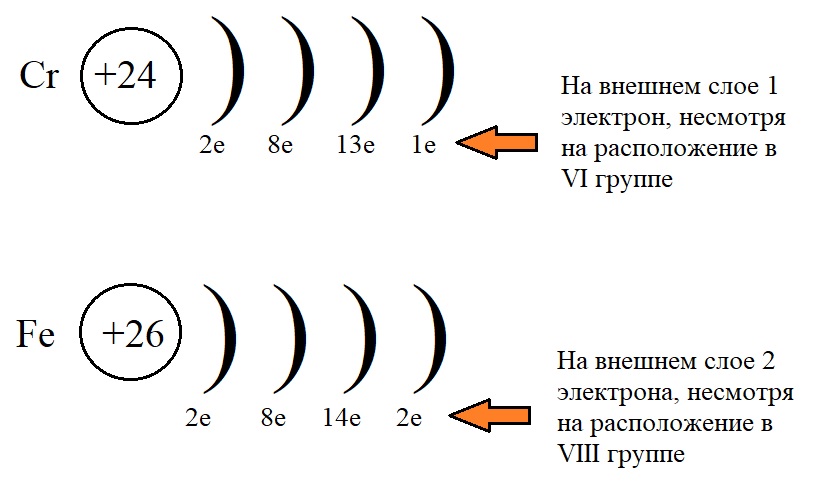 Конфигурация хрома и железа
Конфигурация хрома и железа
На рисунке показано, что несмотря на положение элементов в определенных подгруппах, количество электронов у них не равно этой группе.
Для сравнения изучим еще один рисунок, на котором мы можем сравнить элементы А- и Б-подгрупп одной и той же группы:
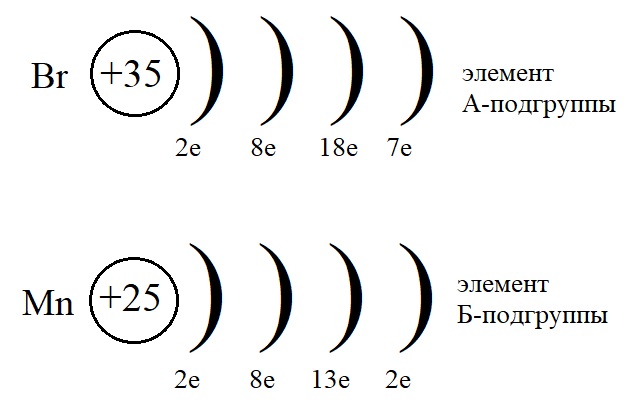
На этом рисунке мы снова можем убедиться, что элементы, находящиеся в одной и той же группе. В одном и том же периоде, но в разных подгруппах имеют разное строение.
Что бы разобраться, почему эти элементы называются d-элементами, разберем структурно-электронные формулы некоторых из них, например, хрома, железа и марганца, строение которых описывалось выше. Как уже было сказано, у этих элементов валентными являются не только внешний. Но и предвнешний уровень.
Cr |
3s2 3p6 3d5 4s1 |
|
|
|
|
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
3s | 3p | 3d | 4s |
Fe |
3s2 3p6 3d6 4s2 |
|
|
|
|
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
3s | 3p | 3d | 4s |
Mn |
3s2 3p6 3d5 4s2 |
|
|
|
|
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
3s | 3p | 3d | 4s |
d-орбиталь содержит неспаренные электроны, которые могут вступать в химическую связь. Поэтому высшая валентность хрома равна не двум (по количеству электронов на внешнем уровне), а шести – по общему количеству электронов внешнего энергетического уровня и d-электронов предвнешнего уровня.
Вы можете встретить немного измененный порядок заполнения орбиталей, например, у марганца: 3s2 3p6 4s2 3d5. s- и d-подуровень поменялись местами, в таких формулах учтен уровень энергии орбиталей: чем меньшей энергией обладает орбиталь, тем быстрее она будет заполняться электронами.
Правильнее будет заполнять электроны в следующем порядке:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p…
Тренировочные задания ЕГЭ
Задание 1.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. |
Определите, атомы каких из указанных элементов имеют электронную конфигурацию внешнего энергетического уровня ns2(n-1) d10
Решение задания:
Для начала разберемся со страшной формулой ns2(n-1) d10. Попробуем заменить переменную n на любое число, например, на 4, тогда мы получим 4s2(4-1)d10 или 4s23d10. Эта формула отображает порядок распределения электронов согласно их энергии. Если для нас такой порядок непривычен, то мы можем поменять его местами, тогда получим 3d104s2. Получившаяся формула приблизительна, вместо нее может быть 4d105s2 или 5d106s2 , но по этой формуле мы понимаем, что должны искать элемент с двумя электронами на внешнем энергетическом уровне (это приводит к тому, что медь выбывает из списка претендентов на правильный ответ), и элемент должен иметь d-орбиталь на внешнем уровне (кальций и стронций выпадают)
Верный ответ: 23
Задание 2.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. |
Определите, атомы каких из указанных в ряду элементов не имеют на внешнем энергетическом уровне неспаренных электронов.
Решение: построим электронные конфигурации данных атомов.
Сурьма – Sb, элемент главной подгруппы пятой группы (А), у таких элементов валентные электроны находятся только на внешнем слое: 5s25p3, что соответствует структурно-электронной формуле:
Элемент имеет три неспаренных p-электрона. | Последовательность расположения электронов на энергетических уровнях выражается следующим рядом чисел:
| ||||||||||||||||
Магний – Mg, элемент главной подгруппы второй группы (А). поэтому его внешний энергетический слой будет имеет следующую формулу: 3s2
Не имеет неспаренных электронов. |
| ||||||||||||||||
Железо – Fe, элемент побочной подгруппы (Б), у таких элементов валентными являются как электроны внешнего уровня, так и d-электроны предвнешнего уровня. 3d64s2
Есть четыре неспаренных электрона на d-подуровне. |
| ||||||||||||||||
Титан -Ti, 3d24s2
Есть два неспаренных электрона на d-подуровне. |
| ||||||||||||||||
Цинк – Zn, 3d104s2
Нет неспаренных электронов. |
|
Верный ответ: 45

 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна  Крылова Елизавета Владимировна
Крылова Елизавета Владимировна 
 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна