Оглавление
- Положение водорода в Периодической системе
- Химические свойства водорода
- Физические свойства
- Получение водорода
- Применение водорода
Положение водорода в Периодической системе
Водород как элемент Периодической системы
 0,050 – приблизительный радиус атома водорода, 2,1 – электроотрицательность по шкале Полинга
0,050 – приблизительный радиус атома водорода, 2,1 – электроотрицательность по шкале Полинга
В некоторых периодических системах можно наблюдать, что водород располагается как в первой, так и в седьмой группе. К первой группе водород относят из-за наличия у него всего одного валентного электрона на внешнем электронном уровне. Это обуславливает существование катионов водорода H+(протонов водорода), которые образуются аналогично катионам металлов IА-группы.
Окисление атома лития и образование катиона лития
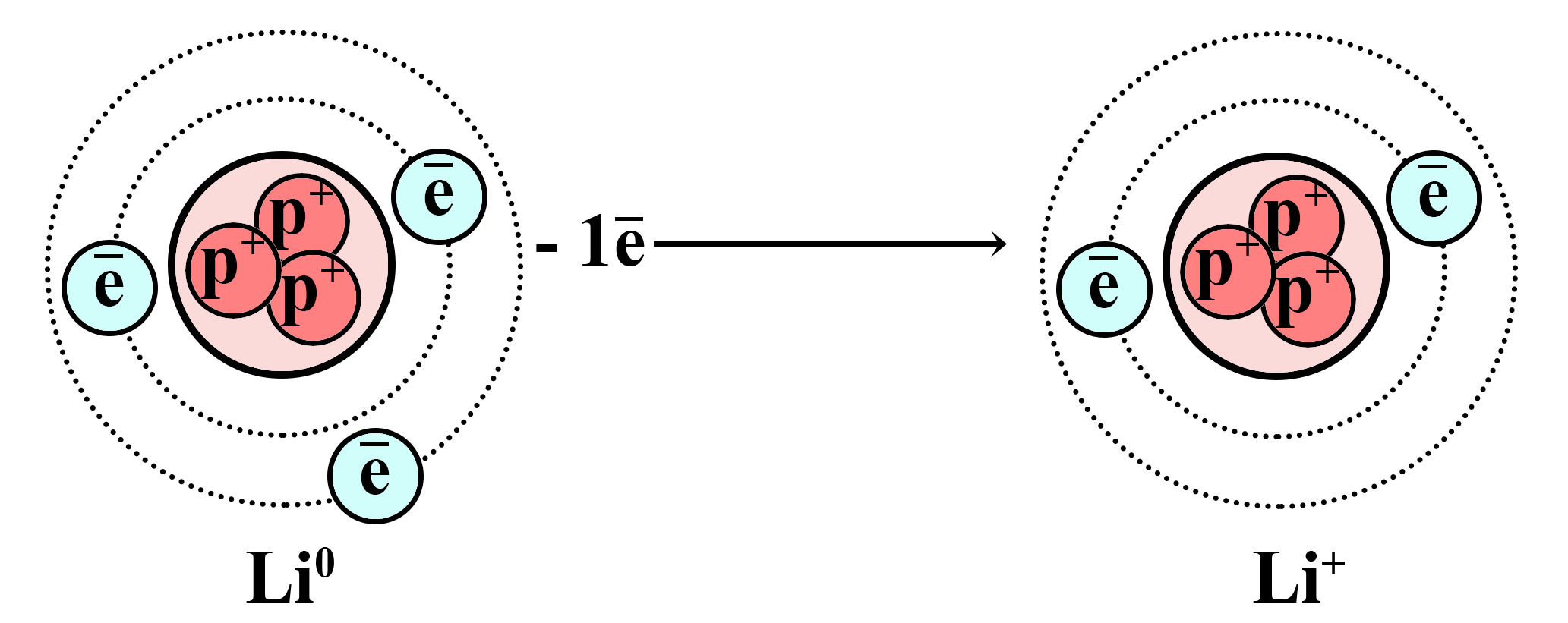 Отдав один электрон внешнего слоя, литий превращается в катион
Отдав один электрон внешнего слоя, литий превращается в катион
Окисление атома водорода и образование катиона (протона) водорода
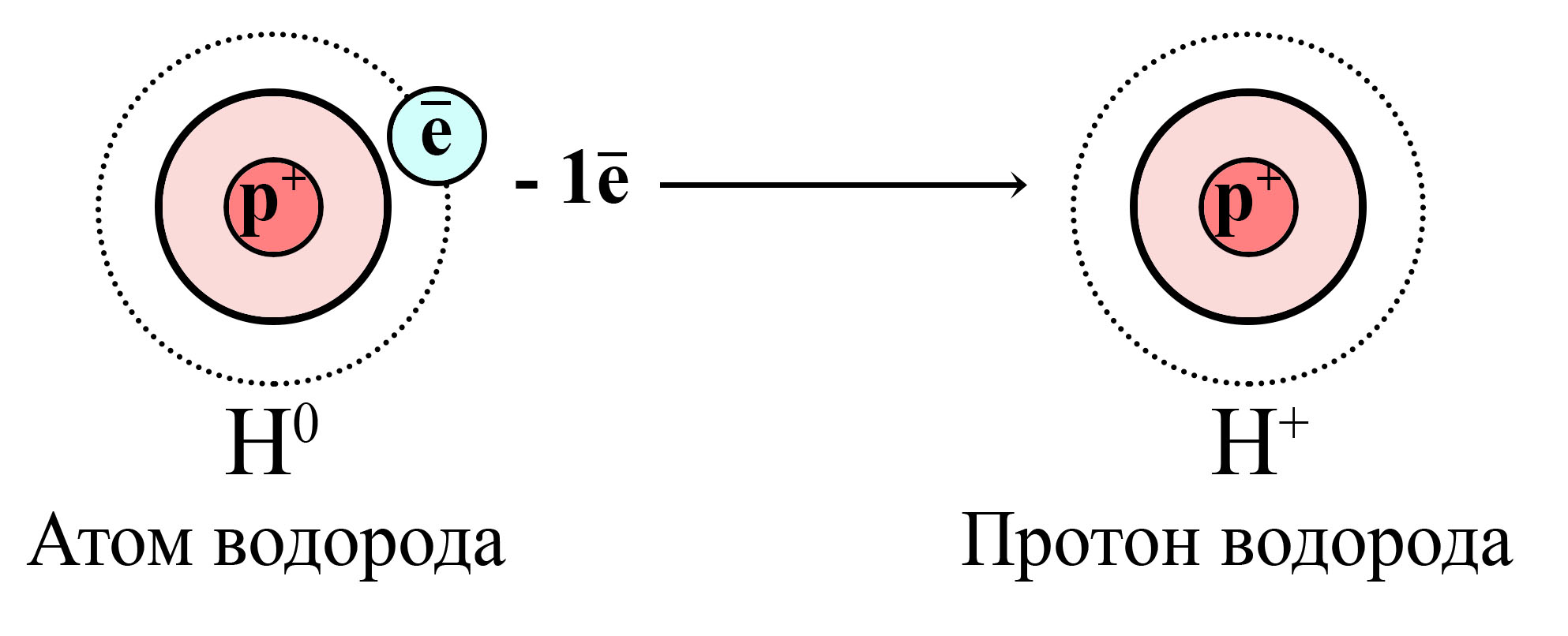 Атом водорода отдает свой единственный электрон, от атома остается только протон
Атом водорода отдает свой единственный электрон, от атома остается только протон
Однако не стоит относить водород к полным аналогам щелочных металлов: в отличие от них, валентный электрон водорода прочнее связан с ядром, так как между ядром и электроном нет других электронных слоёв. Это значит, что есть только силы притяжения положительного ядра к отрицательному валентному электрону, а силы отталкивания между электронами нет. Поэтому положительное ядро водорода может притягивать чужие электроны, а свой единственный электрон не обеспечивает значительной силы отталкивания чужих электронов. Благодаря этому водород может выступать не только в роли восстановителя, отдавая электрон, но и в роли окислителя, образуя гидрид-ион H‒ (принимая электрон) подобно тому, как это делают элементы VIIА-группы. У галогенов на внешнем электронном слое семь валентных электронов, до «идеала» недостает всего одного, поэтому они хорошие окислители (стремятся притянуть чужие электроны).
Восстановление атома фтора до фторид-иона
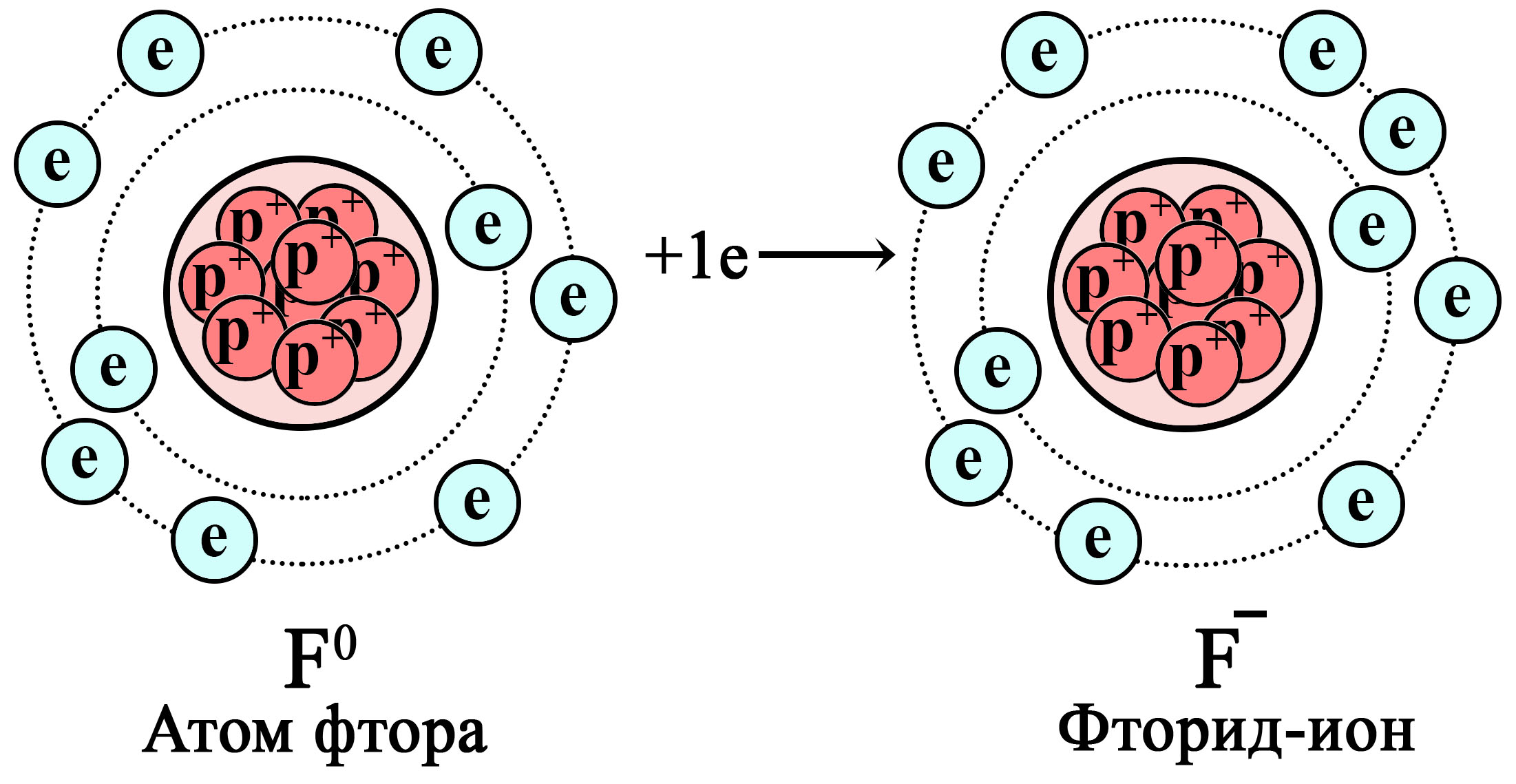 Атом фтора притягивает дополнительный электрон, становясь фторид-ионом
Атом фтора притягивает дополнительный электрон, становясь фторид-ионом
Внешний уровень водорода является еще и первым (ближайшим к ядру), на котором максимально помещается два электрона. До завершения этого уровня атому водорода требуется принять всего один электрон, это роднит его с галогенами. Этим и обосновано расположение водорода в ПС в VIIА-группе. Получая один электрон, водород приобретает конфигурацию благородного газа (гелия).
Водороду не хватает одного электрона до завершенного электронного уровня
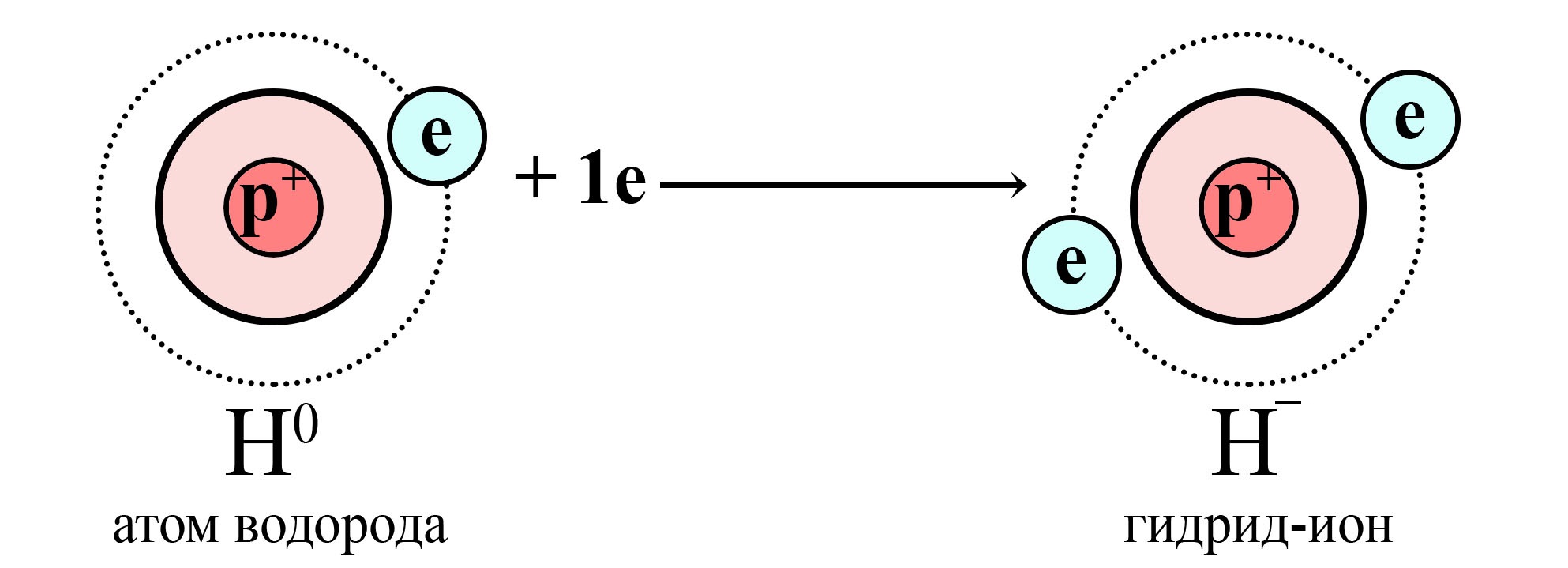 Атом водорода получает электрон от сильного восстановителя и становится гидрид-ионом
Атом водорода получает электрон от сильного восстановителя и становится гидрид-ионом
Таким образом, водород можно рассматривать как элемент первой группы, так как его электронная конфигурация может быть выражена как ns1 (это совпадает с электронной конфигурацией внешнего уровня всех щелочных металлов) и как элемент седьмой группы, так как до завершения внешнего электронного уровня не хватает всего одного электрона.
Задание в формате ЕГЭ с ответом:
Водород имеет конфигурацию благородного газа в следующих соединениях:
- PH3
- NH3
- NaH
- CaH2
- SiH4
- BaH2
Пояснение: Водород приобретает конфигурацию благородного газа, превращаясь в гидрид-ион. Гидриды образуются при взаимодействии водорода с активными металлами (металлами IА-группы и кальцием, стронцием, барием).
Химические свойства водорода
Водород проявляет восстановительные свойства при взаимодействии с неметаллами.
Молекулярный водород состоит из двух атомов, между которых образуется одна, но очень прочная σ-связь, что обеспечивает устойчивость молекулы. Поэтому при нормальных условиях водород малоактивен. Но при нагревании, облучении или использовании катализаторов водород реагирует с большинством неметаллов, а также со щелочными и щелочноземельными металлами.
В качестве катализатора используется платина или никель. Водород, растворяясь в этих металлах переходит из молекулярного в более активное атомарное состояние.
Платина используется как катализатор в реакциях гидрирования
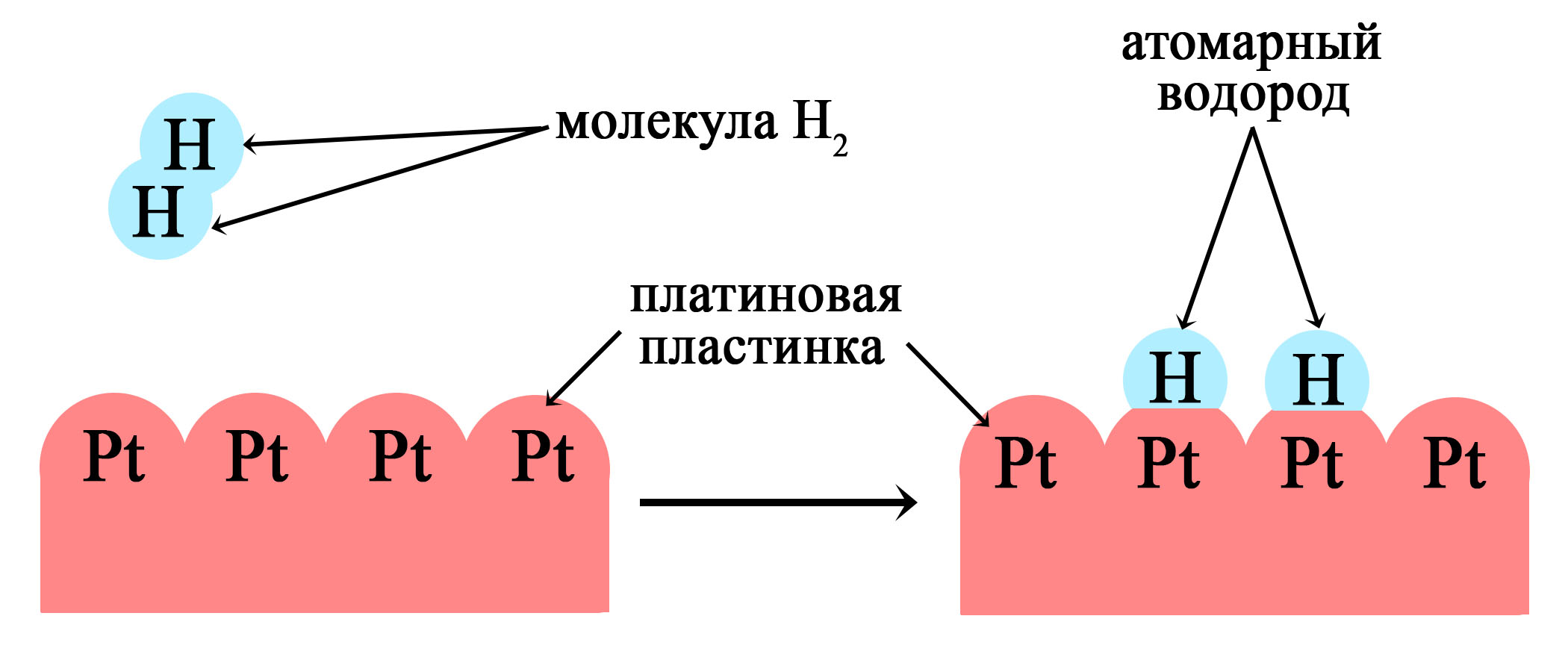 При растворении водорода в металлах он становится атомарным, более химически активным
При растворении водорода в металлах он становится атомарным, более химически активным
- Взаимодействие водорода с галогенами (с элементами VIIА-подгруппы).
При комнатной температуре водород реагирует только со фтором:
H2 + F2 = 2HF
Полученный фтороводород – прозрачный газ с резким запахом, при растворении в воде образует слабую плавиковую кислоту.
При облучении реагирует с бромом и хлором:
H2 + Br2 = 2HBr
H2 + Cl2 = 2HCl
Образовавшийся бромоводород и хлороводород – газы, образующие при растворении сильные кислоты.
При нагревании водород реагирует с йодом:
H2 + I2 = 2HI
Образовавшийся йодоводород – газ, при растворении которого в воде образуется очень сильная кислота.
Кислотные свойства водородных соединений увеличивается в ПС (Периодической системе) слева-направо и сверху-вниз. Поэтому плавиковая кислота слабая, а йодоводородная – сильная.
Пример задания из КИМ ЕГЭ:
Установите последовательность веществ в порядке увеличения кислотности этих соединений:
- NH3
- AsH3
- HCl
- PH3
- HBr
- HI
- Взаимодействие водорода с халькогенами (элементами VIА-подгруппы).
Реакция с чистым кислородом происходит при 400º, с кислородом на воздухе – при 600º, но если использовать платиновый катализатор, то реакция между водородом и кислородом происходит при комнатной температуре:
2H2 + O2 = 2H2O
Данная реакция сопровождается выделением большого количества теплоты, поэтому может быть использована в целях получения энергии в двигателях.
Смесь двух объёмов водорода и одного объёма кислорода называется гремучим газом, она крайне взрывоопасна.
С бором, кремнием и фосфором водород непосредственно не реагирует.
- Взаимодействие водорода с металлами.
Водород проявляет окислительные свойства в реакция со щелочными и щелочноземельными металлами. Принимает от металла один электрон и превращается в гидрид-ион:
2K + H2 = 2KH
Ca + H2 = CaH2
Задание по образцу ФИПИ:
Из предложенного перечня металлов выберите три, с которыми водород может взаимодействовать:
- Fe
- Cu
- Au
- Cs
- Sr
- Rb
Попробуйте решить задание ЕГЭ:
Из предложенного перечня выберете три вещества, с которыми водород не реагирует.
Запишите в поле ответа номера выбранных веществ.
- Ag
- Cl2
- Se
- P
- Si
- Na
- Взаимодействие со сложными веществами
Водород используют для восстановления металлов из их оксидов. Таким образом получают средние и малоактивные металлы (в основном металлы побочных подгрупп):
CuO + H2 = Cu + H2O
FeO + H2 = Fe + H2O
Bi2O3 + H2 = Bi + H2O
Если металл в оксиде может иметь более низкую промежуточную степень окисления, то восстановление происходит не полностью:
Fe2O3 + H2 = 2FeO + H2O
Так как в условиях недостатка водорода восстанавливается не весь оксид железа III, в продукте может образоваться не оксид железа II, а смесь оксида железа II и III (закись-окись железа).
3Fe2O3 + H2 = 2Fe3O4 + H2O
Также неполно восстанавливается и оксид свинца IV.
PbO2 + H2 = PbO + H2O
Для полного восстановления требуется большой избыток водорода.
Железная окалина имеет в своем составе два оксида – FeO и Fe2O3, которые в сумме записывают как Fe3O4 (закись-окись железа). Входящий в состав оксид железа III – более сильный окислитель, за счет него окалина реагирует с водородом.
Fe3O4 + H2 = FeO
Закись-окись марганца, входящая в состав минерала гаусманита, является двойным оксидом (MnO·Mn2O3) с общей формулой Mn3O4 восстанавливается аналогично:
Mn3O4 + H2 = MnO
Водород не восстанавливает металл из оксида:
- CaO
- SnO
- BaO
- PbO
- Li2O
- FeO
Подобным образом восстанавливаются галогениды:
FeCl2 + H2 = Fe + 2HCl
2FeCl3 + H2 = 2FeCl2 + 2HCl
С оксидами и галогенидами активных металлов водород не реагирует.
При 1000ºС водород может восстановить сульфат до сульфида:
BaSO4 + 4H2 = BaS + 4H2O
Водород восстанавливает не только металлы, но и некоторые неметаллы из их оксидов:
2NO + 2H2 = N2 + 2H2O
Восстановление также может происходить не полностью:
CO2 + H2 = CO + H2O
Физические свойства
Водород является газом без цвета и запаха, не имеет вкуса. Это самый легкий газ, его не может удержать земная атмосфера и свободный водород выходит в космос. В земной атмосфере водород остаётся в связанном виде, то есть в составе более тяжелых молекул.
Водород плохо растворяется в воде и во многих других растворителях, но может медленно диффундировать в металлах.
Получение водорода
- Лабораторные методы:
Водород получают взаимодействием 20%-ной серной кислоты с цинком в аппарате Киппа:
H2SO4 + Zn = ZnSO4 + H2↑
Из-за использования загрязненного цинка (цинковые руды загрязнены мышьяком и сурьмой), выход продукта уменьшается, вместе с водородом образуются ядовитые AsH3 и SbH3.
Для получения более чистого водорода используют реакции растворения кремния или алюминия в щелочах:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
Из предложеных пар веществ выберите три, взаимодействие которых приводит к образованию водорода:
- Al и H2SO4конц.
- Fe и HCl
- Fe и NaOH
- Cu и H2SO4разб.
- Mg и HCl
- Zn и KOH
Водород можно получить при реакции железа нагретого до температуры красного каления (900-1000º) с перегретым водяным паром:
3Fe + 4H2O = Fe3O4 + 4H2↑
Взаимодействием щелочных металлов с водой:
Ca + 2H2O = Ca(OH)2 + H2↑
Водород можно получить, растворив в холодной воде металл:
- Zn
- Na
- Ba
- Cs
- Al
- Cu
Реакция является экзотермической – происходит с выделением большого количества тепла. Активные металлы горят и даже взрываются при взаимодействии с водой.
Водород получают гидролизом гидридов или взаимодействием гидрида с кислотой:
KH + HOH = KOH + H2↑
KH + HCl = KCl + H2↑
- Промышленные способы получения водорода:
В промышленности используют электролиз воды и растворов солей активных металлов.
2NaCl + 2H2O = 2NaOH + H2↑ + Cl2↑
Катодный процесс: 2HOH + 2ē → H2 + 2OH‒
Анодный процесс: 2Cl‒ ‒ 2ē → Cl2↑
Водород можно получить электролизом:
- H2O
- NaBr(р-р)
- CuSO4(р-р)
- AgNO3(р-р)
- AuCl3
- BaCl2(р-р)
Водород можно получить при разложении метана при 350ºС на железном или никелевом катализаторе:
CH4 = C + 2H2↑
Наибольшее количество водорода получают воздействием на антрацит (ископаемый уголь с наибольшей массовой долей углерода) перегретым водяным паром (1000ºC):
C + H2O = CO + H2
Или конверсией метана перегретым водяным паром (1100ºС):
CH4 + H2O = CO + 3H2
Смесь угарного газа и водорода, получаемая в этих реакциях, называется синтез-газом. Он используется в органическом синтезе, главным образом для получения метанола и в синтезе Фишера-Тропша для получения алканов:
CO + 2H2 = CH3OH
5CO + 11H2 = C5H12 + 5H2O
Также водород получают глубоким охлаждением коксового газа до ‒196ºС, при такой температуре только водород остаётся газообразным.
Многие описанные методы приводят к получению не чистого водорода, а его смеси с другими газами. Одним из методов отделения водорода от примесей является пропускание газовой смеси через прибор, содержащий трубку из сплава палладия и серебра. Смесь пропускают через прибор под большим давлением. Из-за давления и способности водорода диффундировать в металлах, он попадает в трубку из сплава Pd/Ag, другие газы в эту трубку попасть не могут.
Очистка водорода от примесей
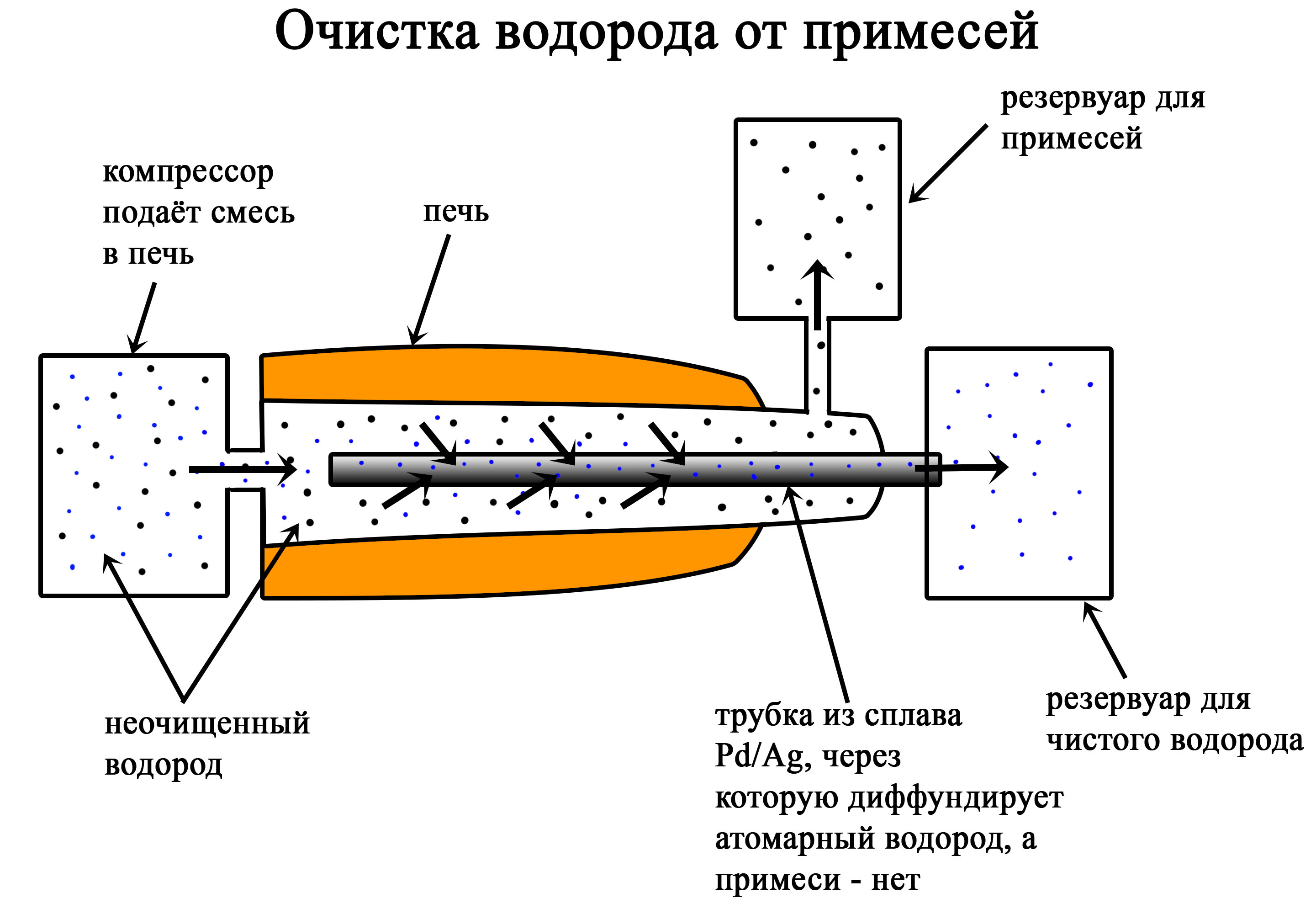 Водород под давлением диффундирует через металлическую трубку
Водород под давлением диффундирует через металлическую трубку
Применение водорода
Наибольшее количество водорода используется в производстве аммиака, хлороводорода и соляной кислоты, восстановление металлов, гидрирование органических соединений, получении метанола.
Жидкий водород используется в качестве ракетного топлива.
Водород используется для очистки нефти от серы.
Использованная литература:
Репетитор по химии / под ред. А. С. Егорова. – Изд. 29-е. – Ростов н/Д : Феникс, 2010. – 762.
Хомченко Г. П. Пособие по химии для поступающих в вузы. – 4-е изд., испр. и доп. – М.: ООО «Издательство Новая Волна»: Издатель Умеренков, 2002.
Шрайвер Д., Эткинс П. Неорганическая химия. В 2-х т. Т.1/Пер. с англ. М. Г. Розовой, С. Я. Истомина, М. Е. Тамм. – М.: Мир, 2004.

 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна  Крылова Елизавета Владимировна
Крылова Елизавета Владимировна 
 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна