Оглавление
- Какие оксиды называют амфотерными?
- Химические свойства амфотерных оксидов
- Получение амфотерных оксидов
Амфотерность – способность веществ проявлять кислотные или основные свойства в зависимости от реагента. Так, оксид алюминия, с кислотными оксидами и кислотами ведёт себя как основный оксид, а со щелочами и основными оксидами – как кислотный оксид.
Какие оксиды называют амфотерными?
К амфотерным относят в основном оксиды металлов +3 и +4 степени окисления, но также можно встретить амфотерные оксиды и в степени окисления «+2».
Таблица 1. – Примеры амфотерных оксидов в различных степенях окисления
Амфотерные оксиды. Получение, химические свойства, образование средних и комплексных солей
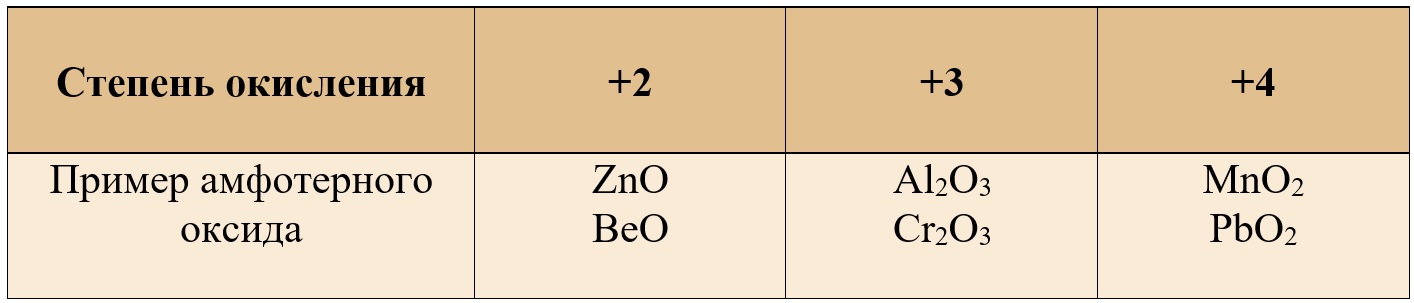 Примеры амфотерных оксидов
Примеры амфотерных оксидов
В таблице представлены лишь самые популярные примеры оксидов, встречающихся на ЕГЭ, многие другие оксиды при различных условиях реагируют как со щелочами, так и с кислотами.
Подробнее о классификации оксидов можно узнать в статье Классификация оксидов
Амфотерность – способность веществ проявлять кислотные или основные свойства в зависимости от реагента. Так, оксид алюминия, с кислотными оксидами и кислотами ведёт себя как основный оксид, а со щелочами и основными оксидами – как кислотный оксид.
Химические свойства амфотерных оксидов
- Амфотерные оксиды проявляют свойств основных оксидов в реакции с кислотами:
ZnO + 2HCl = ZnCl2 + H2O
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
BeO + 2HBr = BeBr2 + H2O
- Амфотерные оксиды проявляют основность при реакции с кислотными оксидами:
ZnO + SO3 = ZnSO4
BeO + N2O5 = Be(NO3)2
- Амфотерные оксиды проявляют свойства кислотных оксидов при взаимодействии со щелочами (растворимыми основаниями). При этом реакция осуществима как в растворах с концентрированными щелочами, так и при сплавлении.
В растворах:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Полученную соль называют тетрагидроксоцинкат натрия
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Полученную соль называют тетрагидроксоалюминат натрия.
Формула полученной соли зависит от количества воды и щелочи, вступивших в реакцию, так в избытке щелочи образуется гексагидроксоалюминат, а не тетрагидроксоалюминат:
Al2O3 + 6NaOH + 3H2O = 2Na3[Al(OH)6]
При сплавлении:
ZnO + 2NaOH = Na2ZnO2 + H2O
Полученная соль называется цинкат натрия.
Al2O3 + KOH = KAlO2 + H2O
Полученная соль называется алюминатом калия (метаалюминат)
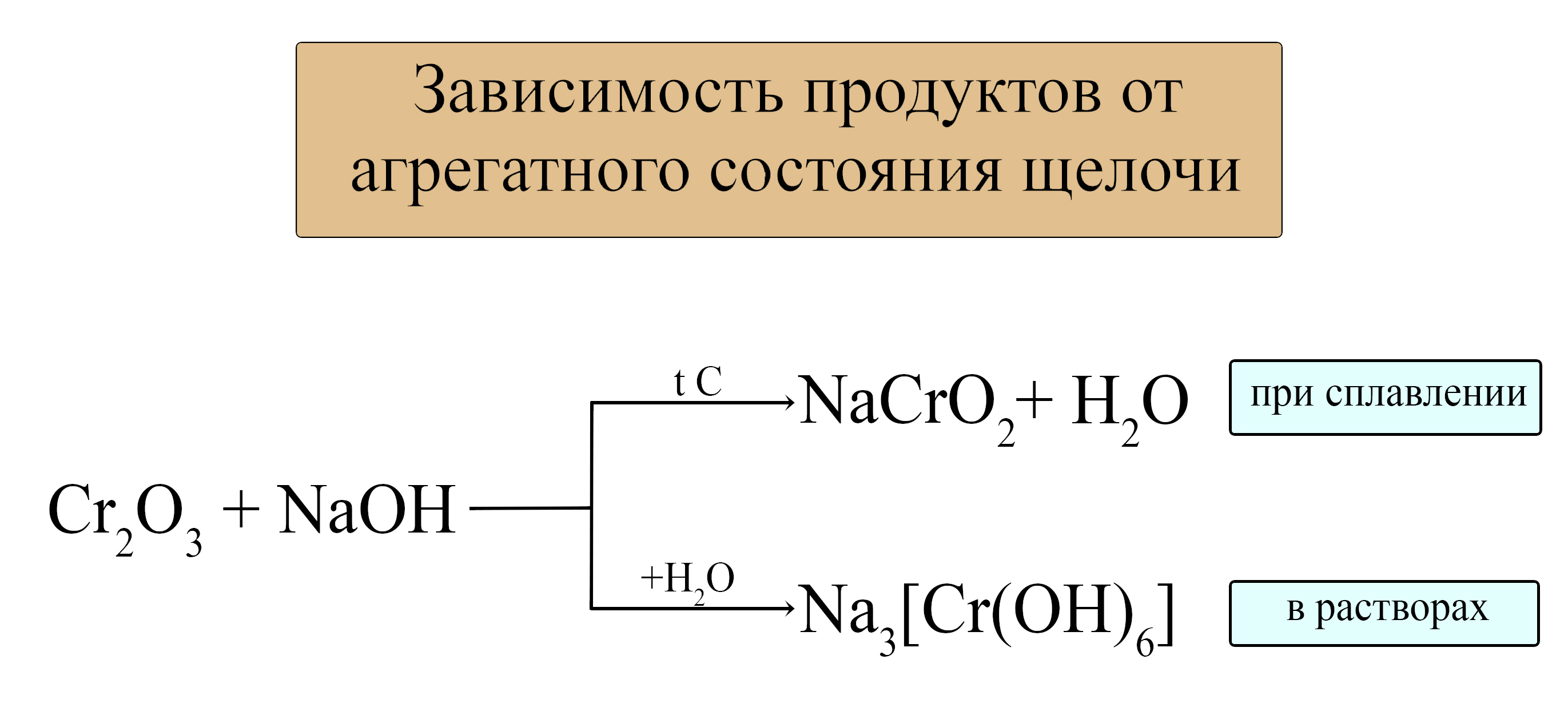
В следующих таблицах приведены некоторые средние и комплексные анионы, в состав которых входят амфотерные металлы.
Таблица 2. – Анионы, содержащие амфотерные металлы в валентности II.
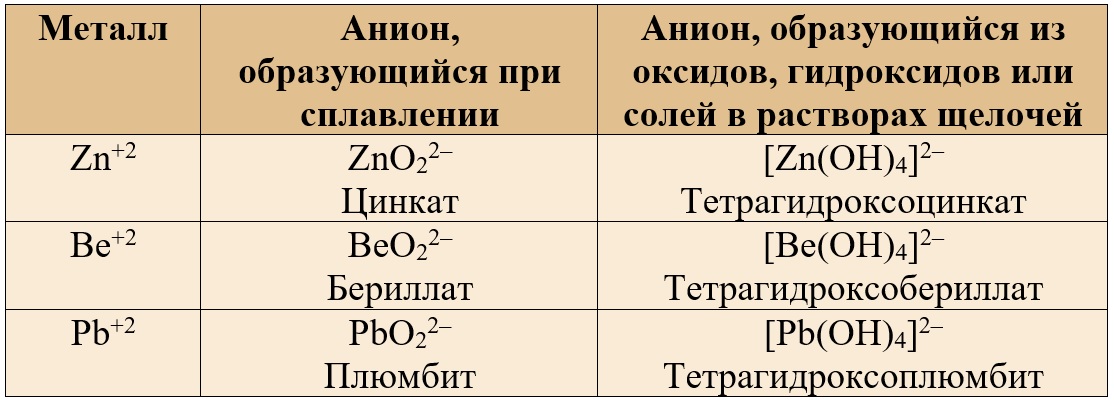
Таблица 3. – Анионы, содержащие амфотерные металлы в валентности III.
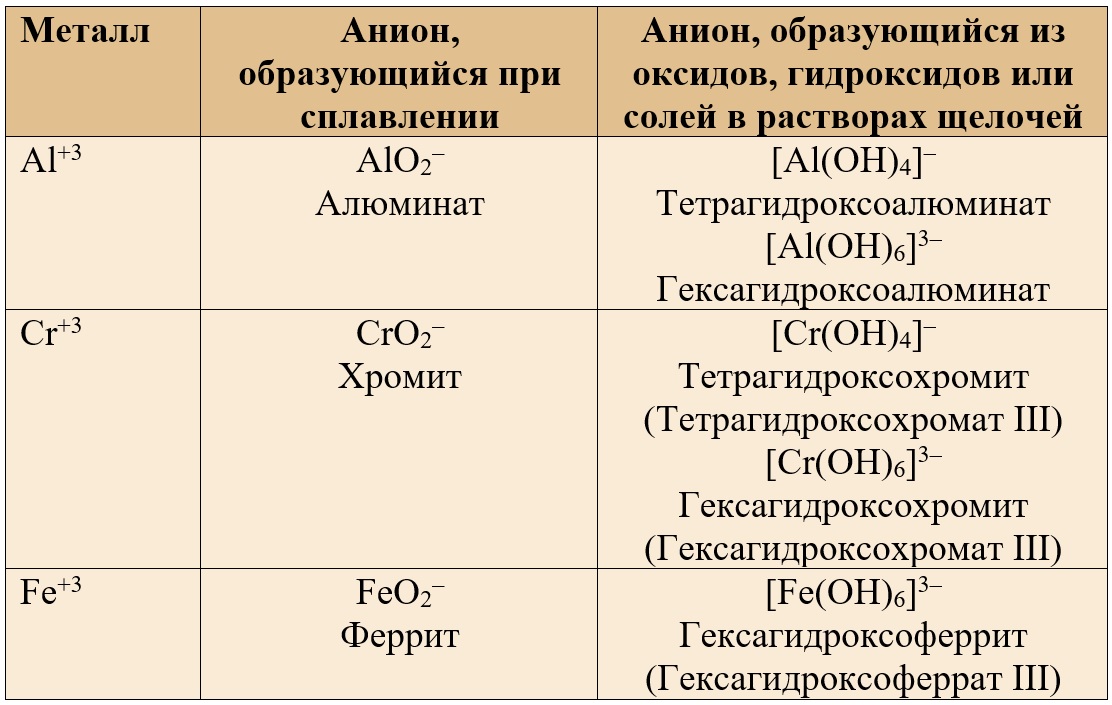
Соли с координационным числом «6» образуются в сильном избытке щелочи.
Таблица 4. – Наиболее распространенные ионы, содержащие амфотерные металлы в валентности IV.
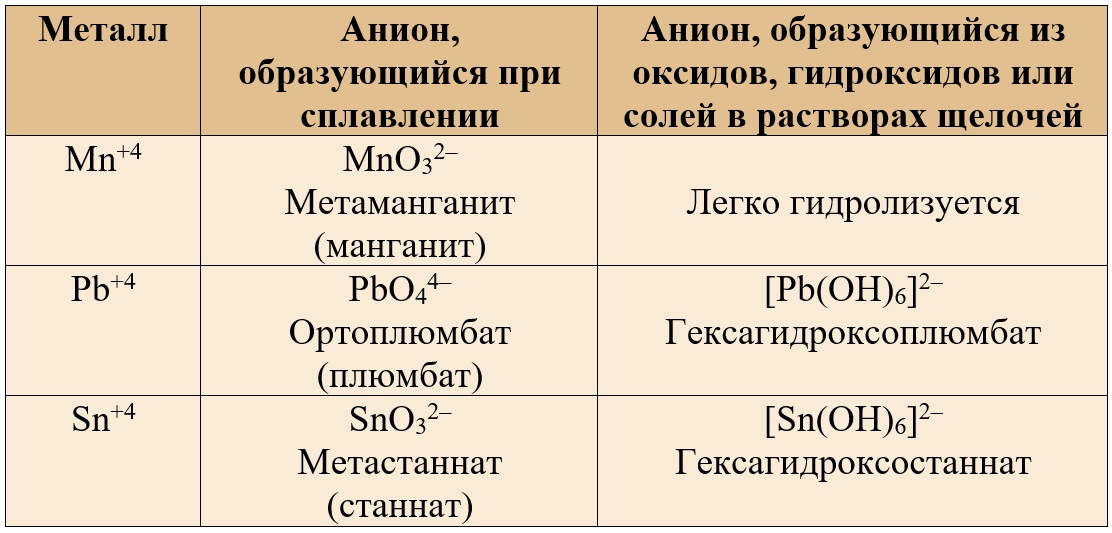
Пользуясь данными таблицами, можно назвать многие соли, например, средние соли:
KAlO2 – алюминат калия
Ca(AlO2)2 – алюминат кальция
NaAlO2 – алюминат натрия
K2ZnO2 – цинкат калия
BaZnO2 – цинкат бария
Na2BeO2 – бериллат натрия
CaBeO2 – бериллат кальция
K2PbO2 – плюмбит калия, содержит свинец (II)
BaPbO2 – плюмбит бария
K4PbO4 – плюмбат (ортоплюмбат) калия, содержит свинец (IV)
Ca2PbO4 – плюмбат кальция
Na2SnO3 – станнат натрия
KCrO2 – хромит калия
NaFeO2 – феррит натрия
И комплексные соли:
K[Al(OH)4] – тетрагидроксоалюминат калия
K3[Al(OH)6] – гексагидроксоалюминат калия
Na2[Zn(OH)4] – тетрагидроксоцинкат натрия
Ca[Zn(OH)4] – тетрагидроксоцинкат кальция
K2[Be(OH)4] – тетрагидроксобериллат калия
Ba[Be(OH)4] – тетрагидроксобериллат бария
Na2[Pb(OH)4] – тетрагидроксоплюмбит натрия
Na2[Pb(OH)6] – гексагидроксоплюмбат натрия
Ca[Sn(OH)6] – гексагидроксостаннат кальция
Na[Cr(OH)4] – тетрагидроксохромит натрия
K3[Cr(OH)6] – гексагидроксохромит калия
Ca3[Cr(OH)6] – гексагидроксохромит кальция
Na3[Fe(OH)6] – гексагидроксоферрит натрия
Как составлять формулы безводных солей?
Например, в реакции участвовал оксид свинца IV и оксид кальция:
PbO2 + CaO = ?
В первую очередь необходимо знать остатки соответствующих кислот, следовательно и формулы кислот, содержащих амфотерный металл. И хоть многие из них не выделены, теоретически мы можем установить их формулы. Для амфотерных металлов в III и IV валентности можно установить орто- и мета-формулы кислот. Для металлов в II валентности выделяют только одну форму кислоты, поэтому для них не указывают уточняющую приставку «орто-» или «мета-», а вывод формулы соответствует выводу как орто- так и мета-формул кислот и их остатков у металлов в III и IV валентности.
Орто-формула соответствует гидроксиду амфотерного металла с учетом того, что в кислоте порядок элементов меняется (водород должен стоять на первом месте).
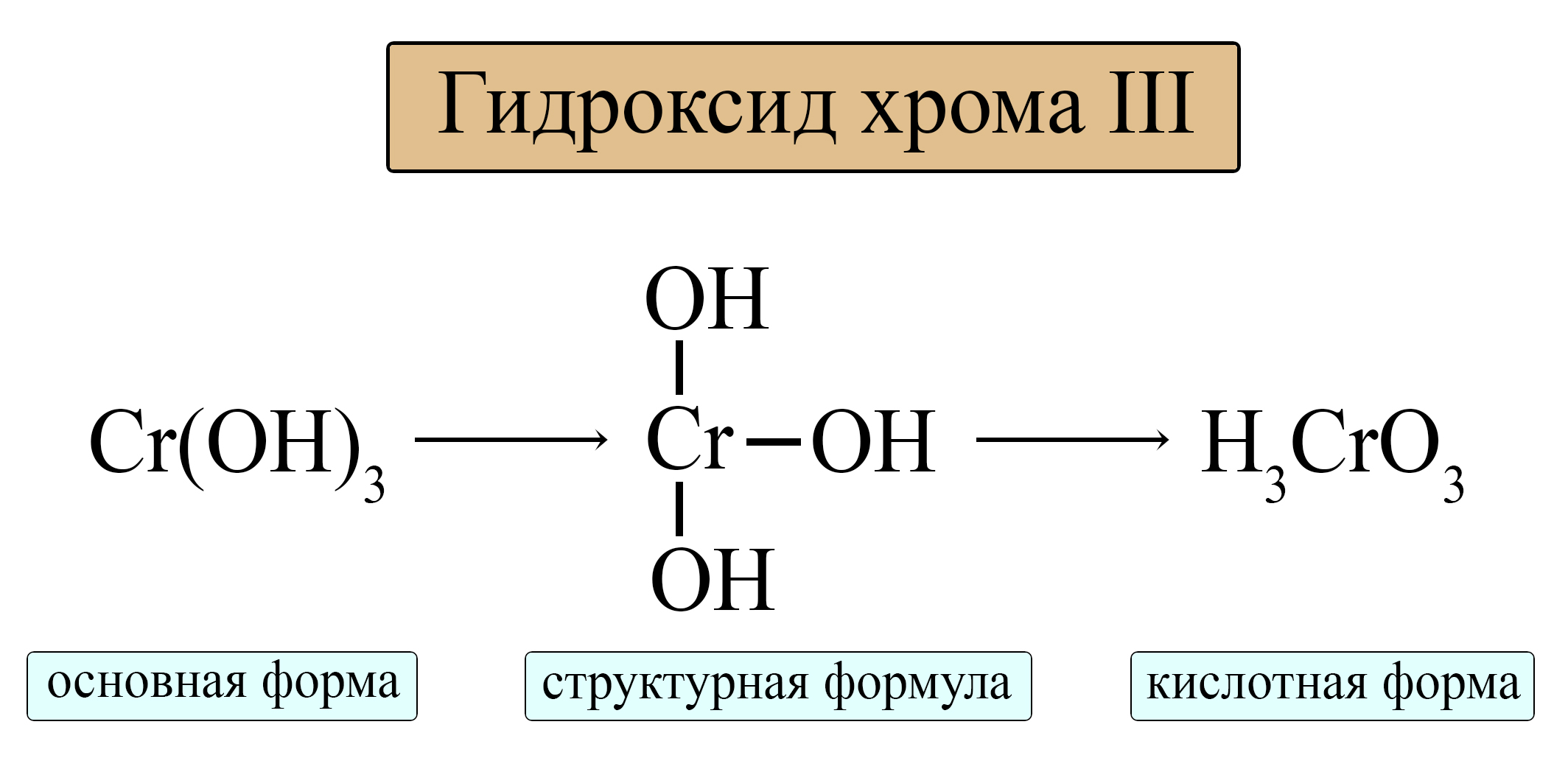
Таблица 5. – Амфотерные оксиды и кислотные остатки, соответствующие им
Для амфотерных металлов в III валентности можно выделить общую формулу орто-кислоты и орто-аниона: H3MeO3 и MeO33-.
Для амфотерных металлов в IV валентности можно выделить общую формулу орто-кислоты и орто-аниона: H4MeO4 и MeO44-.
Таким образом, в реакции оксида свинца IV и оксида кальция можно получить ортоплюмбат кальция:
PbO2 + 2CaO = Ca2PbO4 (ортоплюмбат кальция)
Для этих же металлов можно вывести мета-формулы кислот и их остатков, для этого при образовании формулы используются наименьшие значения индексов. Так, формула орто-хромистой кислоты, как и любого другого гидроксида в кислотной форме, начинается с водорода, а заканчивается кислородом, степень окисления хрома «+3» учитывается при установке индексов:
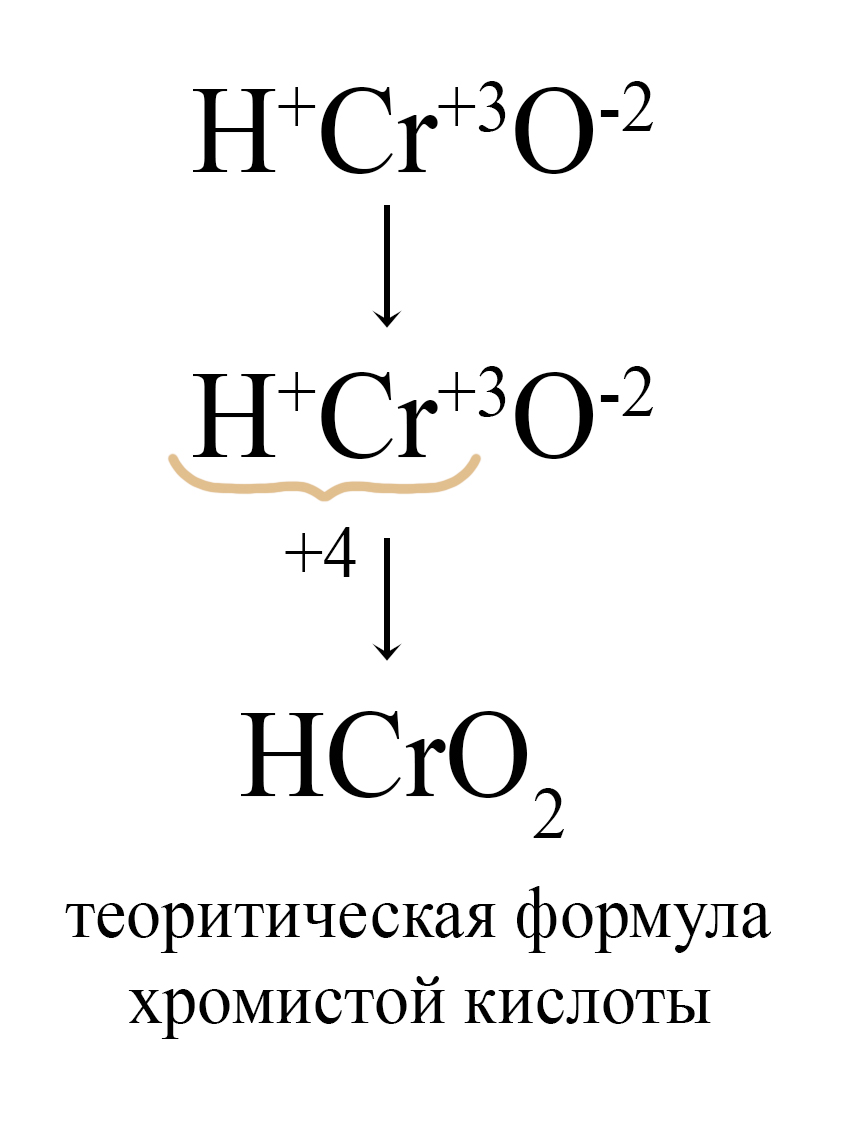
Подробнее о таком способе можно прочитать в статье Свойства кислотных оксидов
Таким образом, оксиду алюминия и оксиду свинца IV соответствуют следующие мета-формулы:
Таблица 6. – Амфотерные оксиды и кислотные остатки, соответствующие им
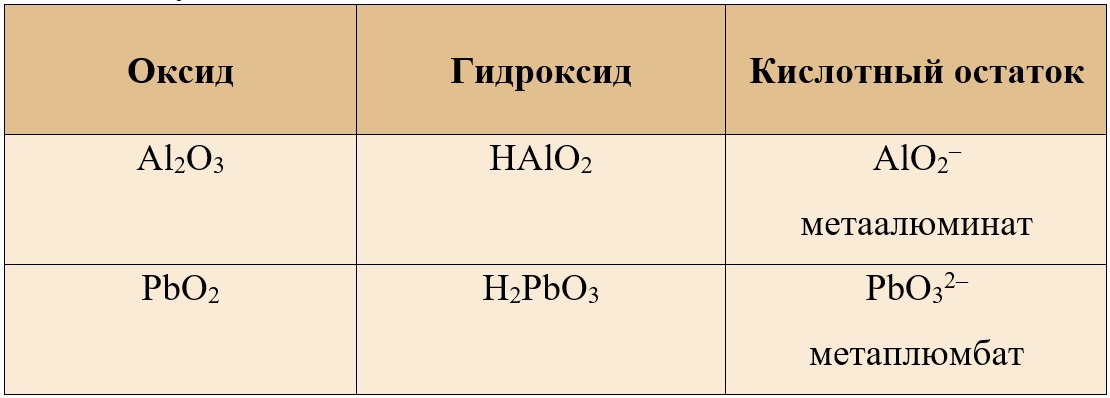
Поэтому в реакции между оксидом кальция и диоксидом свинца может образоваться и метаплюмбат кальция.
PbO2 + CaO = CaPbO3
- Амфотерные оксиды проявляют свойства кислотных в реакциях с основными оксидами. Реакция происходит при сплавлении:
ZnO + CaO = CaZnO2 – цинкат кальция
Fe2O3 + BaO = Ba(FeO2)2 - феррит бария
Al2O3 + SrO = Sr(AlO2)2 – алюминат (метаалюминат) стронция
- Амфотерные оксиды способны вытеснять летучие оксиды из солей:
ZnO + K2CO3 = K2ZnO2 + CO2↑
Al2O3 + Na2SO3 = NaAlO2 + SO2↑
- Как и многие другие нерастворимые оксиды, амфотерные оксиды реагируют с восстановителями (C, CO, H2, NH3, CH4, более активные металлы). Реакции идут только при нагревании.
ZnO + C = Zn + CO↑
Cr2O3 + Al = Al2O3 + Cr
Fe2O3 + Mg = MgO + Fe
Получение амфотерных оксидов
- Термическое разложение амфотерных гидроксидов:
2Al(OH)3 = Al2O3 + 3H2O
Zn(OH)2 = ZnO + H2O
- Прямым взаимодействием металла с кислородом:
2Be + O2 = 2BeO
2Zn + O2 = 2ZnO
4Al + 3O2 = 2Al2O3
Данная реакция не подходит для получения оксида железа III, так как при окислении железа образуется двойной оксид Fe3O4.
- Термическим разложением нитратов. Причем, если в состав катиона входит металл с переменной степенью окисления, в продукте его степень окисления может измениться:
4Fe(NO3)2 = 2Fe2O3 + 8NO2↑ + O2↑
4Cr(NO3)2 = 2Cr2O3 + 8NO2↑ + O2↑
Оксиды хрома и железа в III валентности разлагаются без изменения степени окисления металла:
4Fe(NO3)3 = 2Fe2O3 + 12NO2↑ + 3O2↑
4Cr(NO3)3 = 2Cr2O3 + 12NO2↑ + 3O2↑
- Окислением оксидов с более низкой степенью окисления:
FeO + O2 = Fe2O3
CrO + O2 = Cr2O3

 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна  Крылова Елизавета Владимировна
Крылова Елизавета Владимировна 
 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна