Распределение электронов по подуровням. Разбор первого задания ЕГЭ.
Напомню, что любой энергетический уровень можно разделить на орбитали (подуровни) – области вокруг ядра, в которых с наибольшей вероятностью встречаются определенные электроны. Их распределение не случайно, а согласованно с их энергией.
Для начала, определим максимальное количество электронов на подуровнях:
Распределение электронов по подуровням. Разбор первого задания ЕГЭ.
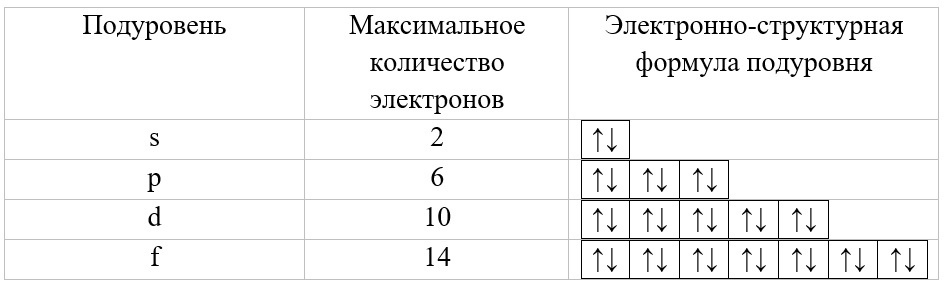 Максимальное количество электронов на подуровнях
Максимальное количество электронов на подуровнях
Каждый уровень начинается с s-подуровня, далее, если количество электронов достаточно большое, заполняется p-подуровень, затем d- и f-орбитали.
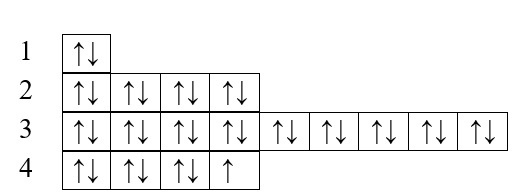
Для лучшего понимания распределения электронов начните с построения планетарной модели атома. Рассмотрим на примере брома.
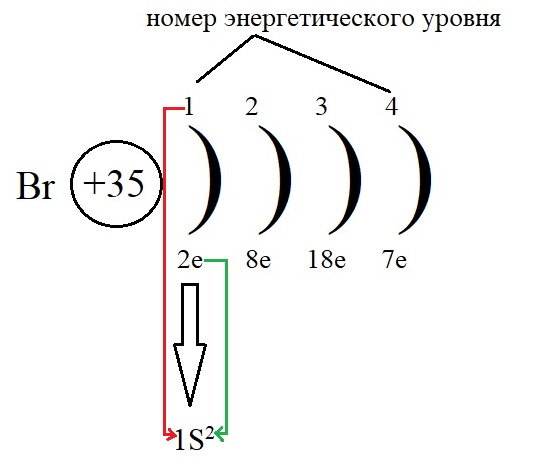
Начинаем запись структуры электронной оболочки атома с обозначения номера уровня, к которому принадлежат электроны (на рисунке обозначено красной стрелкой).
Затем называем подуровень (s, p, d, f).
Определяем количество электронов на этом уровне (зеленая стрелка на рисунке).
На первом уровне всего два электрона, оба поместились на s-подуровне, раз больше электронов на внутренней оболочке нет, может приступить с следующим уровням по тому же алгоритму:
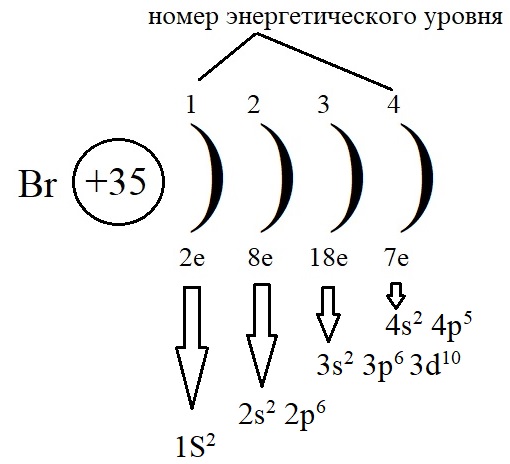
Электронно-структурная формула брома может быть записана двумя распространенными методами
Способ 1. Каждый последующий уровень имеет большую энергию и записывается выше:
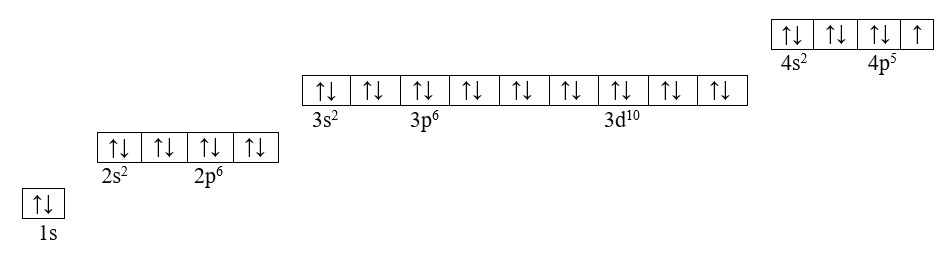
Способ 2. Более компактный, заключается в записи электронов каждого уровня с новой строки:
По электронно-структурной формуле легко понять, что у брома на внешнем уровне есть один неспаренный р-электрон и ему, до завершения внешнего энергетического уровня, не хватает одного электрона.
Попробуем применить полученные знания в решении первых заданий ЕГЭ по химии:
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. |
Задание 1: определите, атомы каких из указанных в ряду элементов имеют три неспаренных электрона в основном состоянии.
Решение: у элементов А-подгрупп неспаренные электроны могут находиться только на внешнем уровне, поэтому далее будем рассматривать только его.

Верный ответ: 14
Обратите внимание на электронно-структурную формулу фтора и мышьяка. Их внешний энергетический уровень можно было записать и другим, к сожалению, неверным способом:
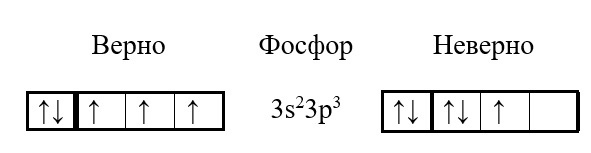
Всё, потому что есть еще одно правило, которым нужно пользоваться при построении структуры атома – правило Гунда (Хунда), которое определяет порядок заполнения электронами внутри орбитали таким образом, чтобы было заполнено как можно больше ячеек.
Рассмотрим еще одно задание:
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. |
Задание 2: определите, атомам каких из указанных элементов до завершения внешнего энергетического уровня не хватает одного электрона.
Решение: для решения данного задания нет необходимости составлять структурные формулы, достаточно знать, что большинства элементов на внешнем уровне наиболее выгодным количеством электронов будет восемь (легко запомнить, так как количество электронов на внешнем уровне определяется по номеру группы, всего групп в ПС восемь, значит, максимум электронов на внешнем слое тоже восемь).
Таким образом, калий, находящийся в первой группе, имеет всего один электрон на внешнем уровне, до завершения внешней электронной оболочки ему не хватает целых семь электронов.
Фтор – элемент седьмой подгруппы, у него семь электронов на внешнем уровне, до «идеальной» оболочки ему не хватает одного электрона. Это первый правильный ответ.
Литий, как и калий относится к первой группе. Ему не хватает целых семь электронов.
Хлор, как же как и фтор, относится к седьмой группе, ему не хватает одного электрона до восьмиэлектронного внешнего энергетического уровня. Это наш второй верный ответ.
Алюминий – элемент третьей группы. До завершения внешнего слоя ему не хватает пять электронов.
Верный ответ: 24
Таким образом всем элементам IА-подгруппы не хватает семи электронов, IIА – шести, IIIА – пяти, IVА – четырех и так далее. Это может вам заметно сэкономить время на экзамене.
Решение задания ЕГЭ химия
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. |
Задание 3: определите, атомам каких из указанных элементов до завершения внешнего энергетического уровня не хватает трёх электронов.
Решение: исходя из вышенаписанного, трех электронов до завершения внешнего энергетического уровня может не хватать элементам пятой группы Периодической системы. Это мышьяк и висмут.
Верный ответ: 45

 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна  Крылова Елизавета Владимировна
Крылова Елизавета Владимировна 
 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна