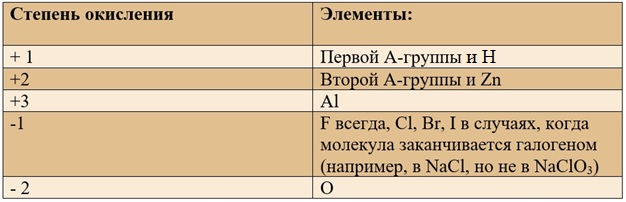
Что такое степень окисления?
Степень окисления – это условная величина, отражающая количество принятых или отданных электронов при образовании заряженной частицы из электронейтрального атома при условии, что электроны переходят от одного атома к другому полностью.
Вспомним, что идеальное количество электронов на внешнем электронном уровне атома равно восьми. Такую конфигурацию внешнего слоя имеют атомы большинства благородных газов (кроме гелия). И к такой электронной конфигурации стремятся атомы других элементов.
Как определить степень окисления
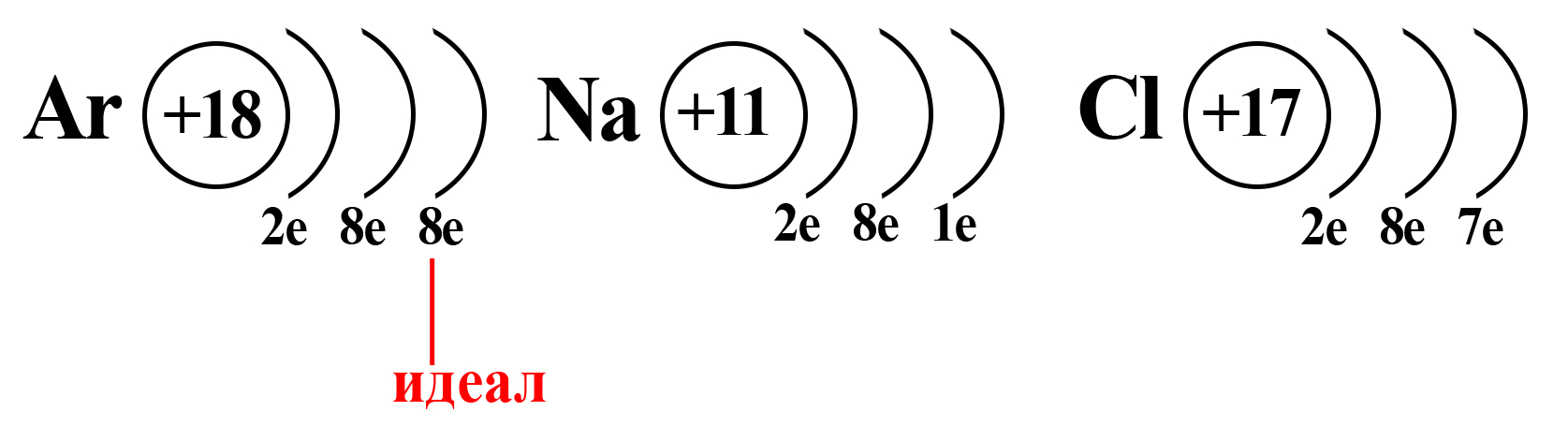 Конфигурация благородного газа
Конфигурация благородного газа
Натрий и хлор не так далеки от «идеала», как может показаться. Если атомы этих элементов столкнуться, внешний электрон натрия притянется на внешний электронный уровень хлора (из-за большей электроотрицательности хлора):
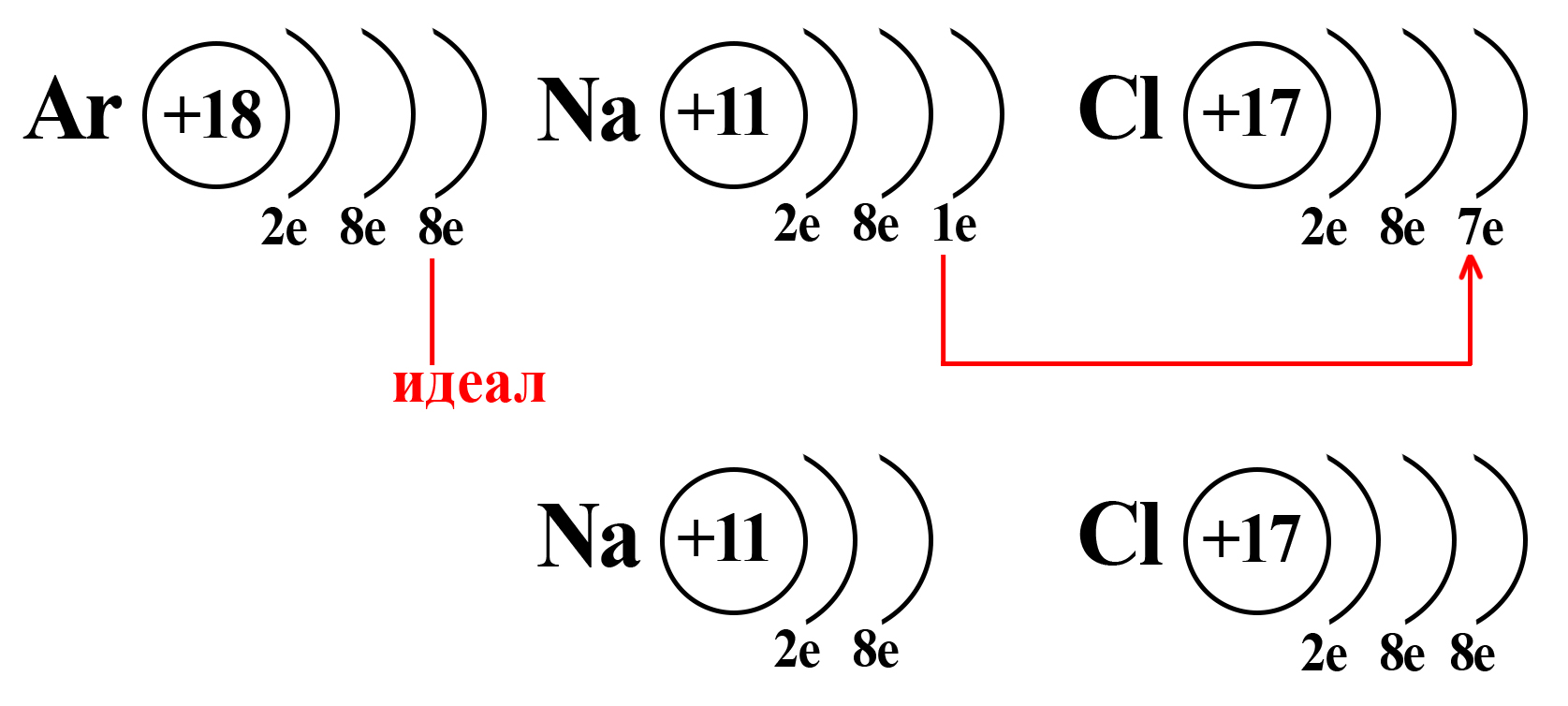
Таким образом, натрий и хлор как будто вступают в симбиоз: натрию, для приобретения «благородной» конфигурации необходимо избавиться от внешнего электрона (при потере внешнего электрона теряется и внешний уровень, а предвнешний уровень, имеющий идеальное количество электронов, становится внешним), тогда как хлору необходимо получить один электрон, чтобы завершить внешний энергетический уровень.
Потеряв один электрон, натрий приобретает положительный заряд, становится катионом (положительно заряженной частицей). Это объясняется тем, что ядро натрия по-прежнему имеет 11 протонов, а вот электронная оболочка, после взаимодействия с хлором, содержит 10 электронов. Таким образом, натрий будет иметь 11 положительно заряженных частиц и 10 отрицательно заряженных частиц. По простейшему уравнению: +11 – 10 = +1, становится ясно, откуда взялся положительный заряд.
Аналогичный расчет можно привести и для хлора. После взаимодействия с натрием ядро атома хлора не изменяется, оно содержит 17 положительно заряженных частиц (протонов), а оболочка – 18 отрицательно заряженных частиц (электронов). +17 – 18 = ‒1.
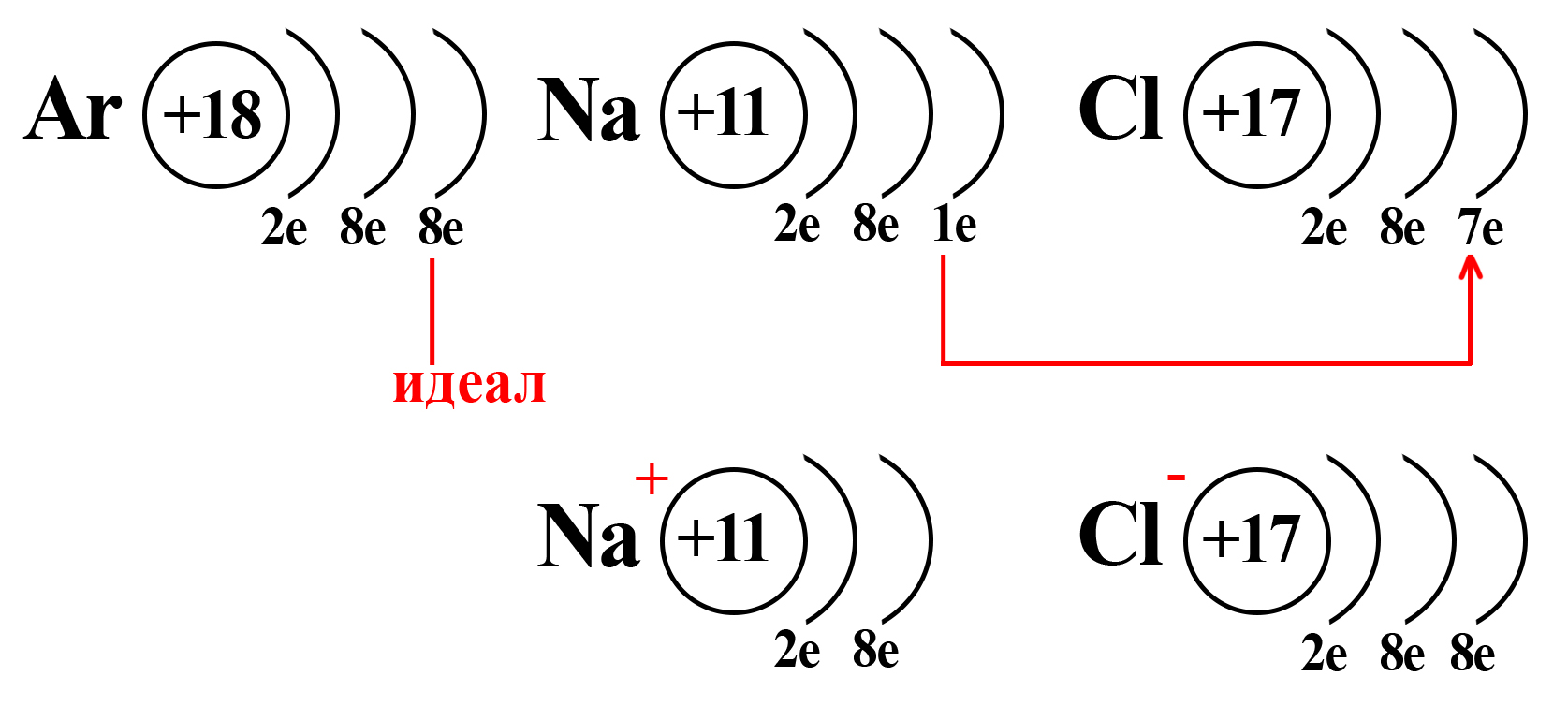
Полученные заряды и являются степенями окисления.
Также степень окисления можно выразить количеством электронов, которые иону нужно получить или отдать для того, чтобы стать электронейтральным атомом. Так, катион натрия, имеющий заряд «+1», должен получить 1 электрон, чтобы превратиться в атом натрия: Na+ +1ē = Na0. А анион хлора (хлорид-ион), имеющий заряд «‒1» должен отдать один электрон: Cl- -1ē = Cl0.
Для упрощения понятие «степень окисления» применяется не только для веществ с ионным строением (металл + неметалл), но и для веществ с ковалентными полярными связями. Несмотря на то, что в таком типе связи полного перехода электронов от одного атома к другому не происходит, полученные частичные заряды превращаются в целые.
Постоянные степени окисления.
Знания этой простой, базовой темы помогут Вам решать не только тестовые задания. Одно из самых сложных заданий ЕГЭ – расстановка коэффициентов с помощью электронного баланса – не решается без знания степеней окисления.
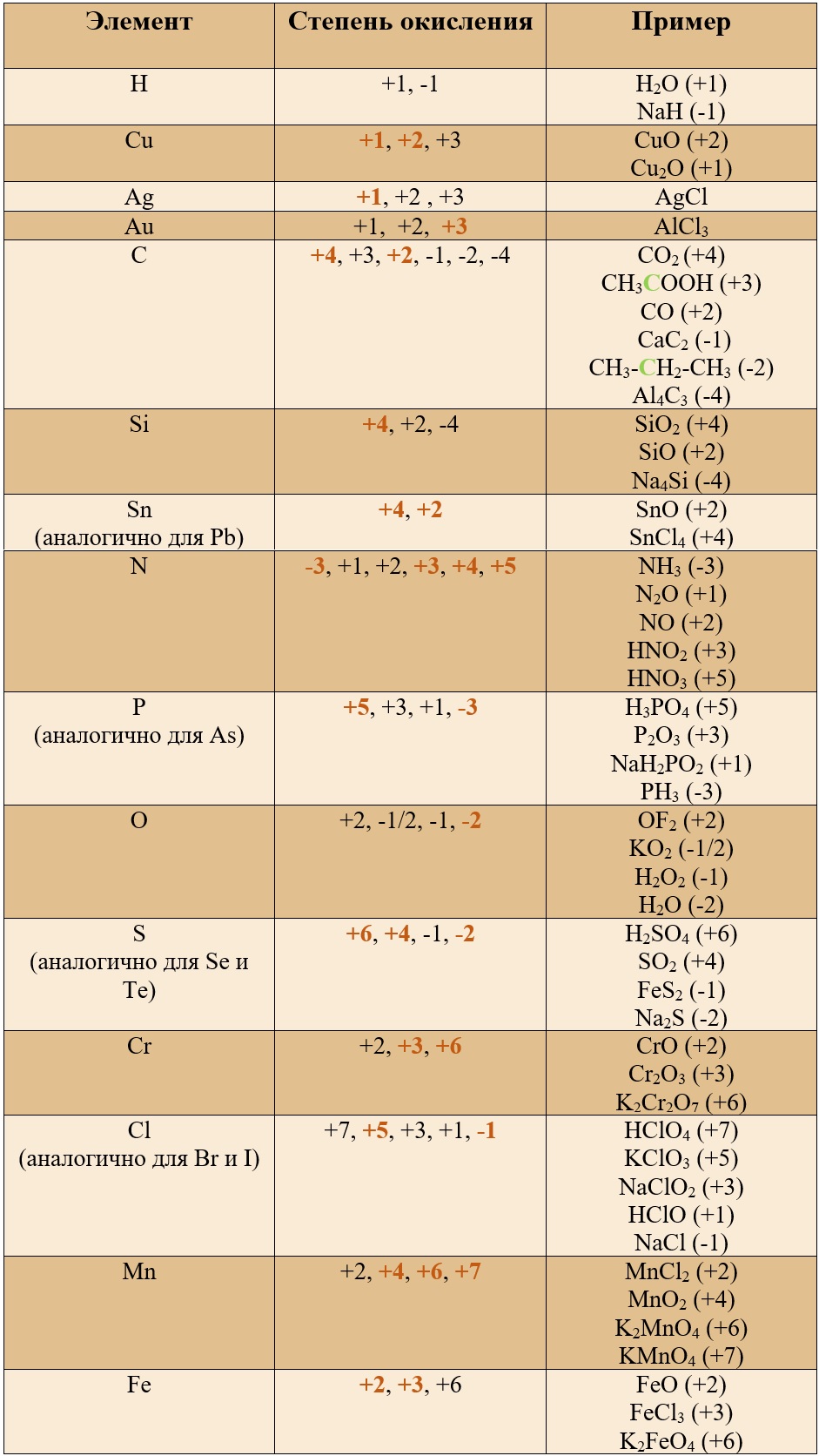
Таблица «Элементы, имеющие постоянную степень окисления»
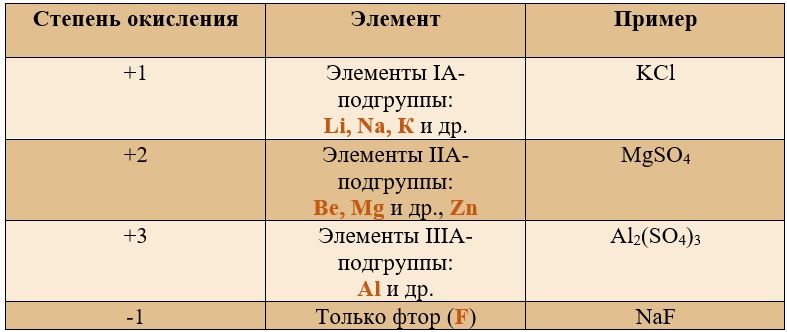
Таблица «Наиболее популярные степени окисления у остальных элементов» (Выделены бурым)*
*В таблице указаны не все возможные степени окисления.
Таким образом, медь, серебро, золото и железо не проявляют высшей степени окисления, равной номеру группы, у остальных же элементов высшая степень окисления равна номеру группы.
Для определения степени окисления не нужно учить всю таблицу, и тем более все степени окисления. Они приведены для справки, наиболее важными являются:
Определение степеней окисления в бинарных соединениях
Для примера возьмём оксид фосфора (P2O5)
- Определим степень окисления известного элемента (в нашем случае это кислород).

- Условно разделим молекулу на две части: чаще всего первая часть молекулы положительная, а вторая – отрицательная (искл: NH3 и PH3).

- Индекс после кислорода указывает на, что в молекуле содержится пять атомов кислорода, каждый из них имеет степень окисления «-2», поэтому общее количество отрицательных зарядов будет равно «-10».
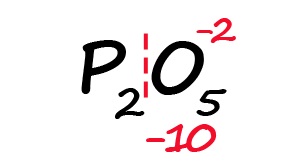
- Молекула должна быть электронейтральной, то есть количество положительных и отрицательных зарядов должны быть равными. Из этого следует, что все атомы фосфора в данной молекуле в сумме должны иметь десять положительных зарядов.
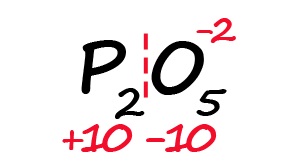
- Индекс «2» после фосфора означает, что в молекуле содержится два атома фосфора, между которыми поровну нужно разделить общий положительный заряд (+10:2=+5)
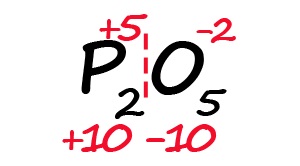
Аналогичным образом происходит определение степени окисления в более сложных веществах, для примера возьмём перманганат калия (KMnO4):
- Подпишем степени окисления для элементов, имеющих постоянные их значения:

- Разделим молекулу на положительный и отрицательный «полюс» (в соединениях, состоящих из атомов трех элементов, чаще всего первые два являются положительными, а третий - отрицательным).

- Посчитаем общее количество положительных и отрицательных зарядов с учетом индексов:
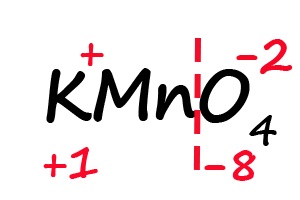
- Ответим на вопрос: какого количества плюсов не хватает, что бы положительные и отрицательные заряды имели одинаковое значение? До +8 не хватает семи положительных зарядов, откуда следует, что степень окисления марганца равна «+7».
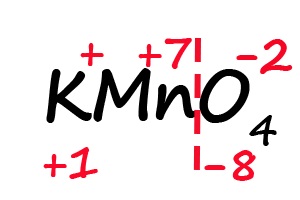
Ну и напоследок разберем степени окисления элементов в дихромате калия (K2Cr2O7):
- Подписываем известные степени окисления:
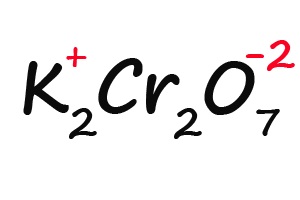
- Делим молекулу на положительную и отрицательную части:
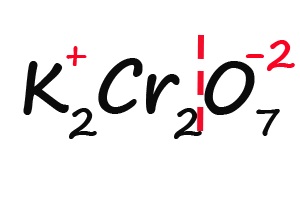
- Считаем общее количество «плюсов» и «минусов»:
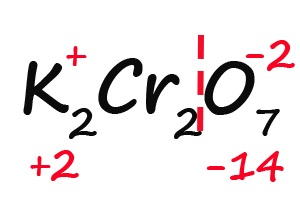
- Подсчитываем, сколько положительных зарядов не достает для того, чтобы молекула стала электронейтральной (т. е. такой молекулой, в которой количество положительных и отрицательных зарядов было одинаковым):
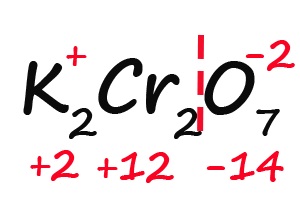
- Так как молекула содержит два атома хрома, двенадцать положительных зарядов должны распределиться между ними поровну, то есть, каждый хром имеет заряд +6:
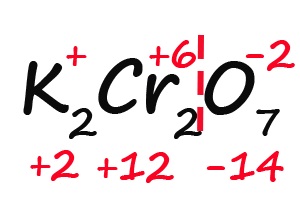
Как быть, если в формуле встретились скобки? Например, как посчитать степень окисления брома в пербромате кальция?

- Для начала определим все известные степени окисления, как делали в предыдущих примерах:
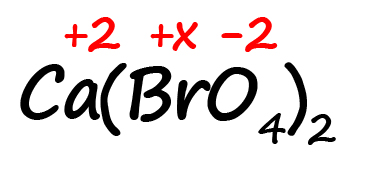
- Посчитаем сумму положительных и отрицательных зарядов. Важно учесть все индексы. Помните, что индекс. Расположенный за атомом действует только на этот атом, а индекс, расположенный за скобкой, действует на всё содержимое скобок:
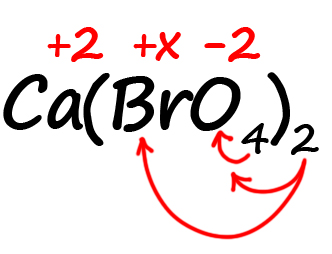
Таким образом, в пербромате кальция содержится: один атом кальция, два атома брома и 8 атомов кислорода (индексы, относящиеся к одному и тому же атому перемножаются).
Следовательно, мы имеем два положительных заряда от кальция и шестнадцать отрицательных от кислорода. Так как индекс «2» за скобками действует и на бром, его заряд можно выразить как 2х.
Получаем уравнение:
2 + 2х ‒ 16 = 0
2х = 14
х = 7
Степень окисления брома в пербромате кальция равна «+7».

 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна  Крылова Елизавета Владимировна
Крылова Елизавета Владимировна 
 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна