Влияние строения на физические и химические свойства.
- Неподеленная электронная пара азота в аммиаке и аминах
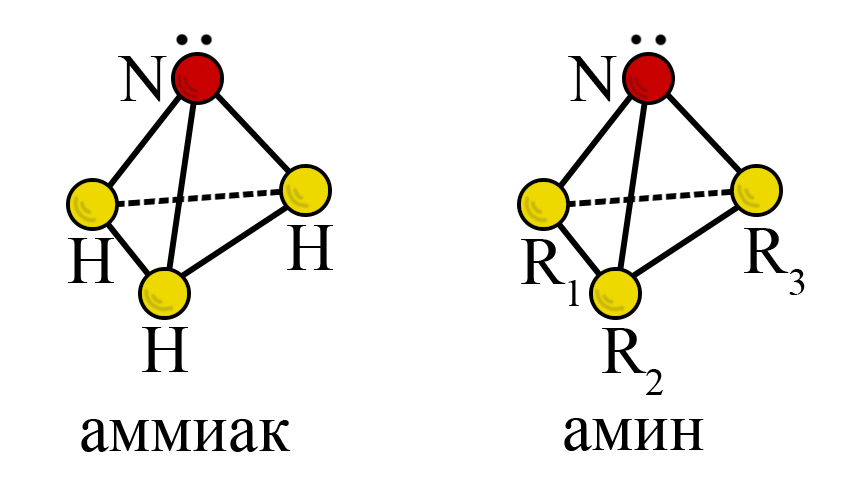
Атом азота в аминах имеет неподеленную пару электронов (2s2), вследствие чего амины являются нуклеофилами (дословно: «любящий, тянущийся к ядру»).
Откуда у азота неподеленная пара? Сравним конфигурацию азота и фосфора.
Строение и физические свойства аминов
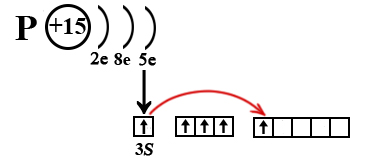 Возбужденное состояние атома фосфора
Возбужденное состояние атома фосфора
Фосфор содержит 15 электронов, расположенных на трех уровнях. Количество электронов на внешнем уровне в основном состоянии у азота и фосфора одинаково, так как оба элемента относятся к VА-подгуппе. Распределение электронов на внешнем уровне в основном состоянии соответствует формуле ns2np3. Однако, у фосфора есть дополнительная свободная d-орбиталь, а у азота её нет (дополнительной d-орбитали нет у элементов, имеющих менее трех энергетических уровней, то есть у элементов 1 и 2 периода). Благодаря свободной d-орбитали 3s-электроны могут разделиться (один из пары переходит на свободную d-орбиталь), в таком случае фосфор окажется в возбужденном состоянии и для него будет характерна валентность V (3s13p33d1) за счет пяти неспаренных электронов.
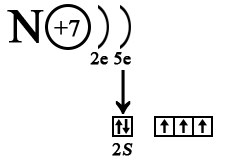
Из-за отсутствия свободной d-орбитали у азота его 2s электроны не могут разделиться, поэтому и называются «неподеленной парой», их обозначают двумя точками над элементом. Эта неподеленная пара притягивает к себе положительно заряженные частицы (положительный заряд частица имеет, когда количество протонов в ядре превышает количество электронов, окружающих его), поэтому вещества, имеющие элемент с неподеленной электронной парой называют нуклеофилами.
- Образование донорно-акцепторной связи в аммиаке и аминах
Нуклеофильность проявляется в образовании аммиаком и аминами четвёртой ковалентной связи по донорно-акцепторному механизму, когда неподеленная пара притягивает к себе протон водорода. Рассмотрим данный процесс на примере образования катиона аммония, катионы алкиламмония образуются аналогичным образом.
Три неспаренных электрона 2p-орбитали участвуют в образовании трех ковалентных полярных связей с тремя атомами водорода, при этом у азота остается неподеленная свободная пара на внешнем (валентном) уровне.
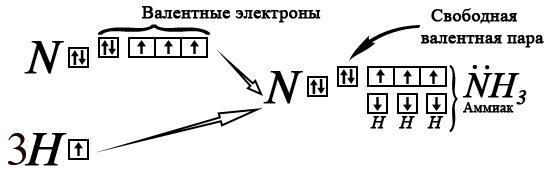
Эта пара притягивает протон водорода, образуя донорно-акцепторную связь с ним, при этом азот является донором пары, а водород – акцептором.
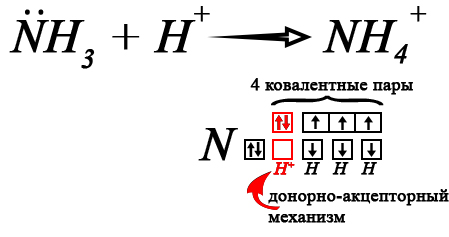
Протон водорода обычно образуется в кислотах, таким образом, аммиак и амины хорошо реагируют с кислотами, проявляют основные свойства (являются основаниями Льюиса, то есть веществами, притягивающими протон водорода).
- Основность аминов в сравнении с аммиаком
Первичные, вторичные и третичные амины присоединяют один протон водорода, превращаясь в катион. Аналогичная реакция характерна и для аммиака (в ходе этой реакции образуется катион аммония).
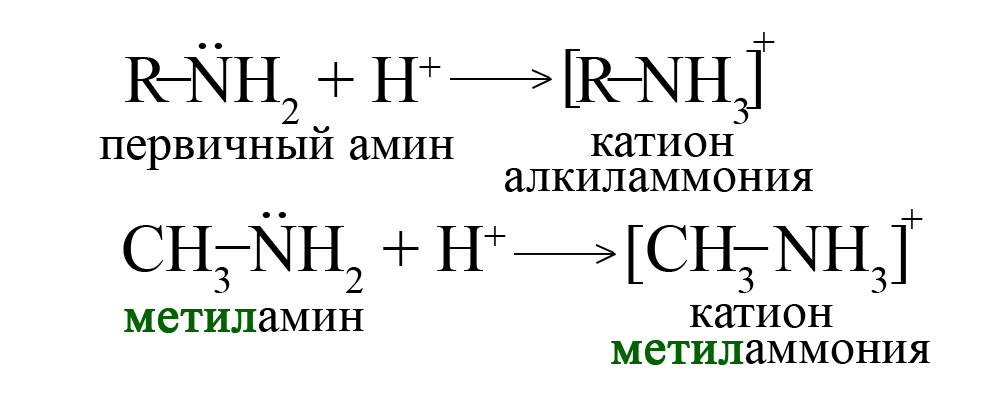
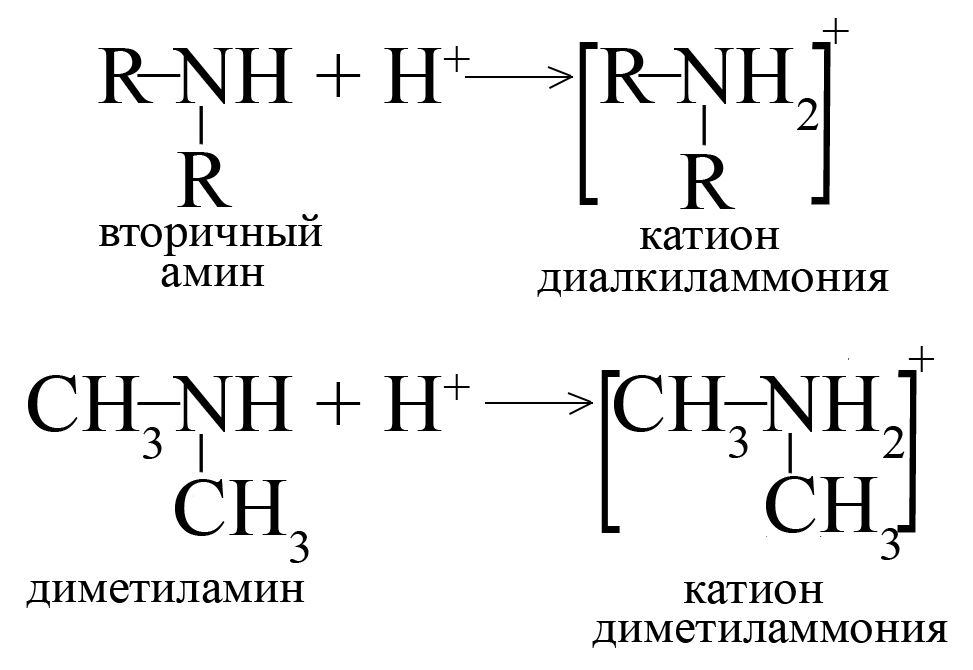
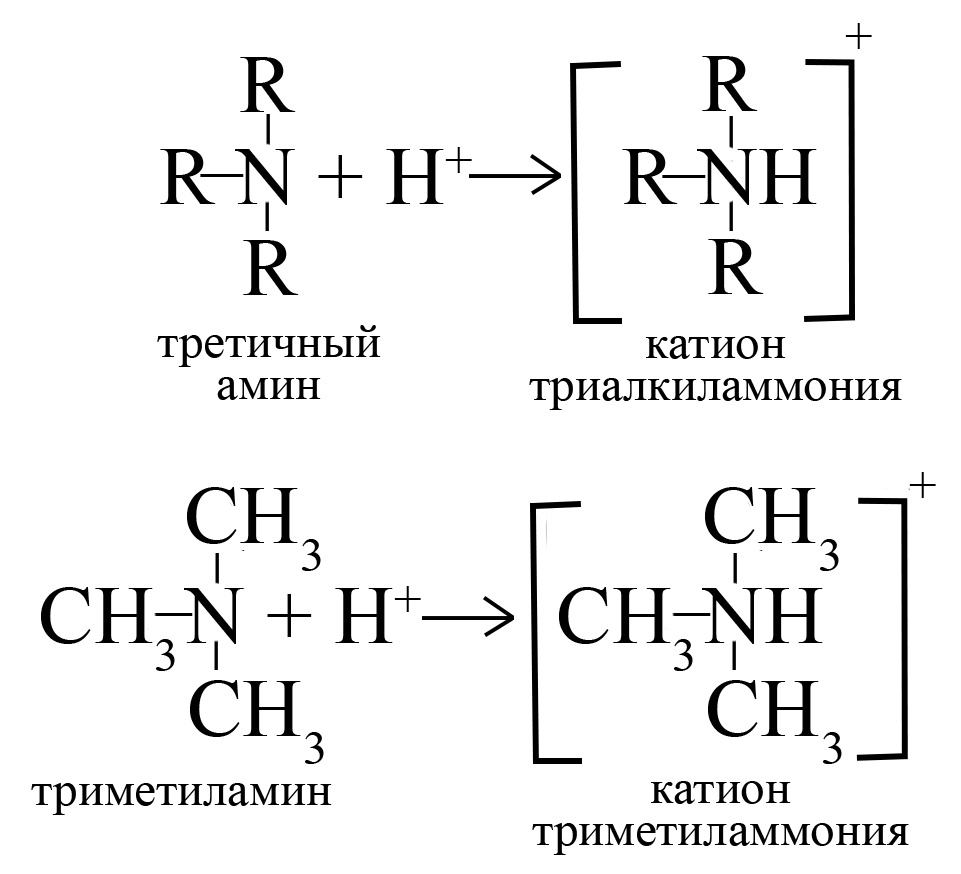
Скорость реакции первичных, вторичных и третичных аминов с одной и той же кислотой отличается. Чем основнее амин, тем быстрее идет реакция с кислотой.
Любой алифатический амин проявляет более сильные основные свойства, чем аммиак, это можно объяснить положительным индуктивным эффектом. Молекула аммиака состоит из азота и трех атомов водорода. Более электроотрицательный азот притягивает на себя электронную плотность от водорода. То же касается и аминов, но у азота в аминогруппе есть возможность притянуть электроны не только от водорода, но и от алкильного радикала, таким образом, на азоте в аминах концентрируется большая чем у аммиака электронная плотность, что способствует притягиванию протона водорода, а значит, увеличивает основные свойства аминов.
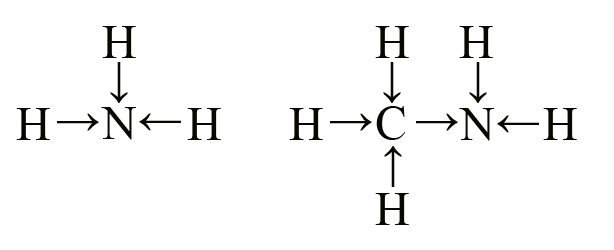
Можно предположить, что чем больше алькильных радикалов, тем более основным будет амин, так как каждая алькильная группа вносит свой положительный индуктивный эффект. Такое утверждение характерно для газообразных аминов.
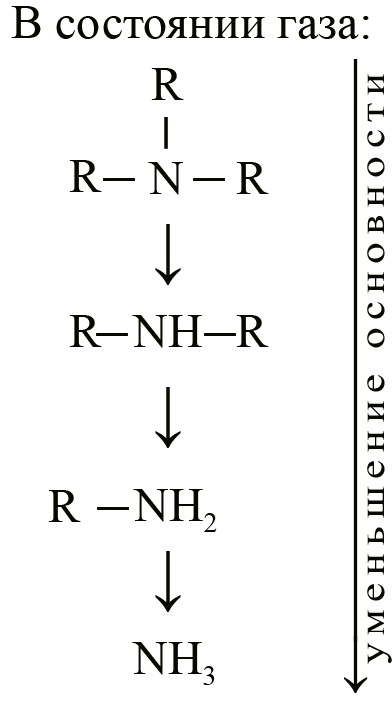
Однако, в растворах ситуация изменяется:
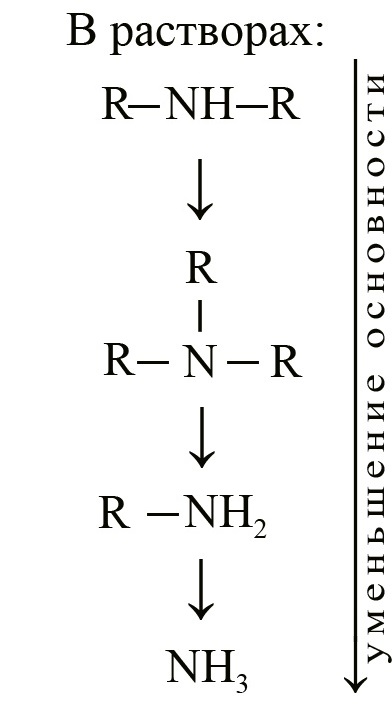
Третичные амины уступают вторичным в основности. Это объясняется сольватацией третичного амина молекулами воды, что мешает присоединению протона водорода.
- Строение молекулы
Азот в аммиаке и аминах находится в sp3-гибридизации и имеет форму тетраэдра (тригонально-пирамидальную форму). Угол связи составляет 107,3º.
- Физические свойства аминов
Низшие амины являются газами при нормальных условиях, их запах похож на запах аммиака. Легко воспламеняются.
Амины со средними молекулярными массами являются жидкостями с запахом гниющей рыбы.
Амины с большой молекулярной массой не имеют запаха, являются твёрдыми веществами.
Большинство аминов, кроме высокомолекулярных, хорошо растворимы в воде, образуют водородные связи.
Таблица «Физические свойства аминов»

- Растворимость и образование водородных связей
Амины, как и аммиак, хорошо растворимы в воде благодаря своей полярности (вода – полярный растворитель, полярные вещества хорошо растворяются в полярных растворителях).
Рассмотрим на примере аммиака (для аминов характерно аналогичное строение, но один, два, либо три атома водорода будут замещены на алкильный радикал, например, на – CH3 или на – C2H5 и так далее).
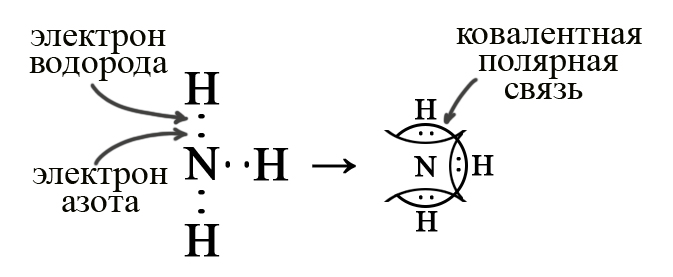
В молекуле аммиака содержится три ковалентные полярные связи, эти связи не зря так названы: более электроотрицательный азот притягивает к себе общие электронные пары и становится частично отрицательным, а атомы водорода – частично положительными; таким образом создаётся два полюса (+ и ‒).
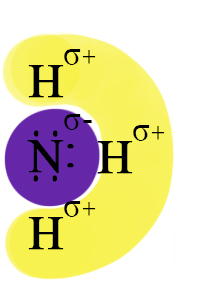
Амины еще более полярны, так как положительный индуктивный эффект алкильного радикала увеличивает электронную плотность на атоме азота.
Растворимость изомерных аминов не одинакова и уменьшается от первичных аминов к третичным. Так пропиламин растворяется лучше, чем метилэтиламин, а тот, в свою очередь, растворяется лучше, чем триметиламин.
Амины, как и аммиак, образуют межмолекулярные водородные связи за счет притяжения более положительного водорода одной молекулы к более отрицательному азоту другой молекулы.
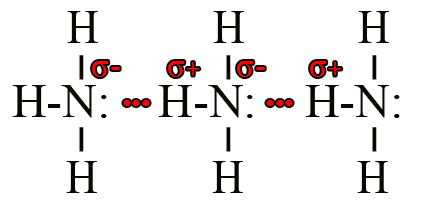
Водородные связи в аминах несколько слабее водородных связей в аналогичных спиртах, так как азот менее электроотрицателен, чем кислород. Следовательно полярность связи в аминогруппе менее выражена, чем в гидроксильной группе из-за чего и ослабевает межмолекулярное притяжение.
Образование водородных связей характерно для первичных и вторичных аминов, но не для третичных.

 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна  Крылова Елизавета Владимировна
Крылова Елизавета Владимировна 
 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна