Порядковый номер, группа и период.
Для удобства будем использовать планетарную модель строения атома Н. Бора, согласно которой в центре атома располагается положительно заряженное ядро, состоящее из протонов и нейтронов, а вокруг двигаются электроны по «орбитам» и образуют электронную оболочку
Вся необходимая для построения модели атома информация находится в Периодической системе химических элементов Д.И. Менделеева:
Порядковый номер элемента равен количеству протонов (р+) в ядре этого атома, так у лития три протона, у бериллия – четыре, а у натрия одиннадцать. Известно, что атом – нейтральная частица, количество протонов в ней всегда будет равно количеству электронов. Поэтому порядковый номер определяет не только заряд ядра, но и общее количество электронов на всех орбиталях атома этого элемента.
Строение атома
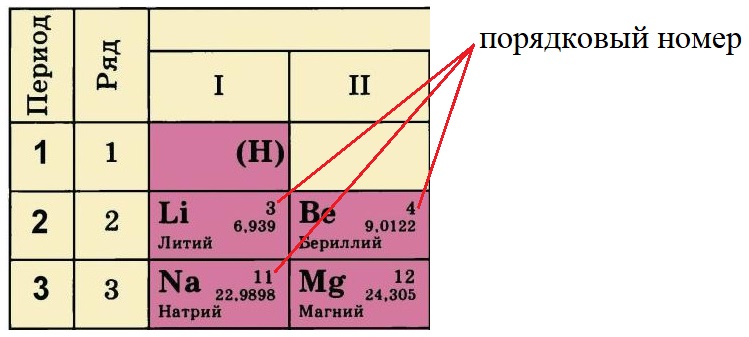 Порядковый номер в таблице Менделеева
Порядковый номер в таблице Менделеева
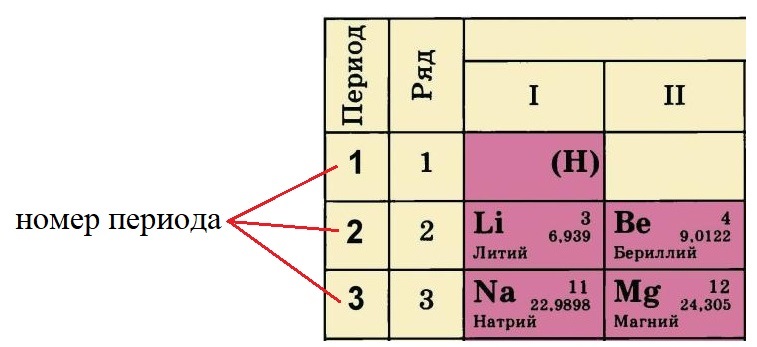
Номер периода, в котором располагается данный элемент, показывает, на каком количестве уровней находятся электроны. Так, электроны лития и бериллия располагаются на двух уровнях, а натрия и магния – на трёх.
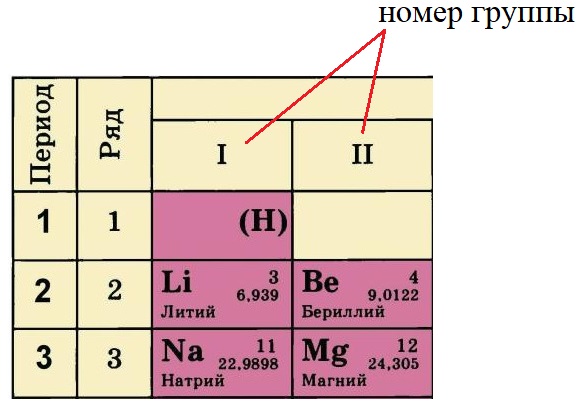
Номер группы, в котором стоит элемент определяет количество электронов на внешнем уровне (валентные электроны). У лития и натрия по одному электрону на внешнем уровне, а у бериллия и магния – по два. Это правило действует только на элементы А-подгрупп.
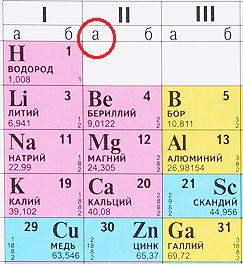
А-подгруппа и Б-подгруппа.
Как определить, какой элемент относится к А-подгруппе, а какой – к B (Б)-подгруппе?
Некоторые таблицы содержат эту информацию:
Но большинство таблиц имеет только обозначения групп. Что делать в таком случае? Всё просто: ориентируйтесь по элементам второго периода, они все являются элементами А-подгрупп (литий, бериллий, бор, углерод, азот, кислород, фтор, неон), те элементы, что располагаются прямо под ними тоже относятся к А-подуровню:
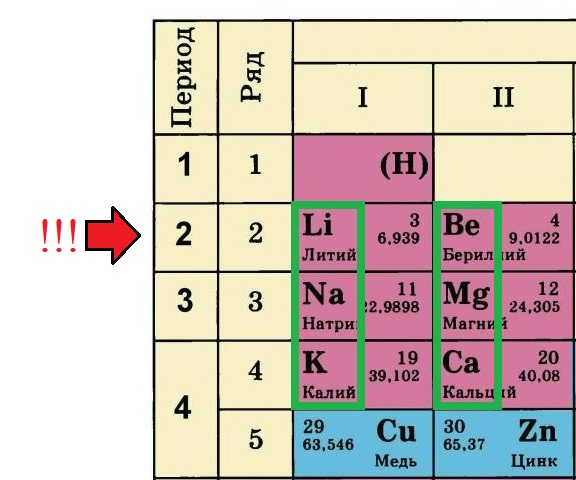
В данном примере зеленым прямоугольником выделены элементы А-подгрупп, так как с них начинается второй период ПС. А значок меди и цинка расположен с другой стороны, это элементы В-подгрупп.
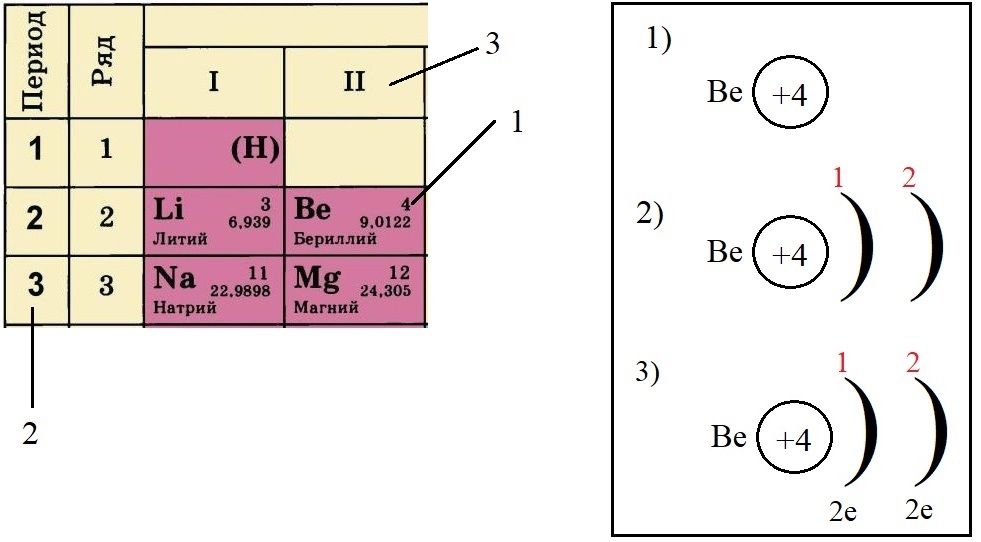
Пример построения модели атома.
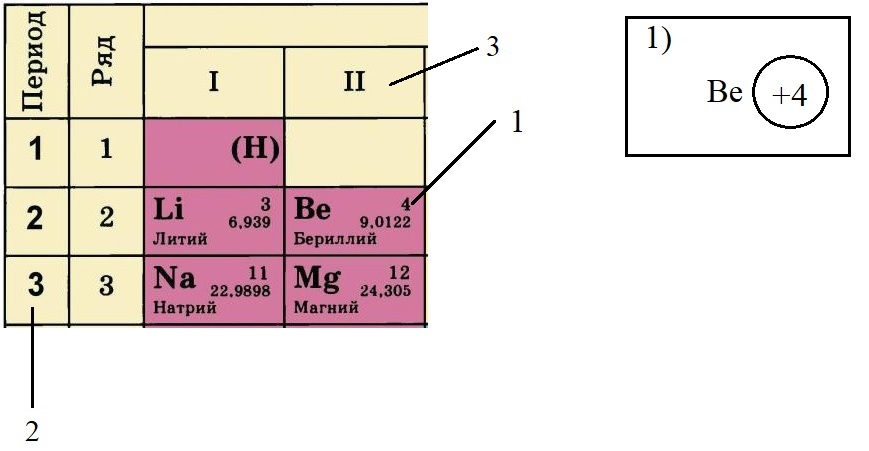
Теперь попробуем составить электронную конфигурацию атома бериллия. Последовательность действий отображена цифровыми обозначениями на рисунке, изображающем фрагмент ПС:
По порядковому номеру определяем заряд ядра, записываем в круг после символа элемента. Помним, что это еще и количество электронов.
Определяем количество энергетических уровней, оно равно номеру периода, в котором стоит элемент. Бериллий стоит во втором периоде, значит, у него два энергетических уровня:
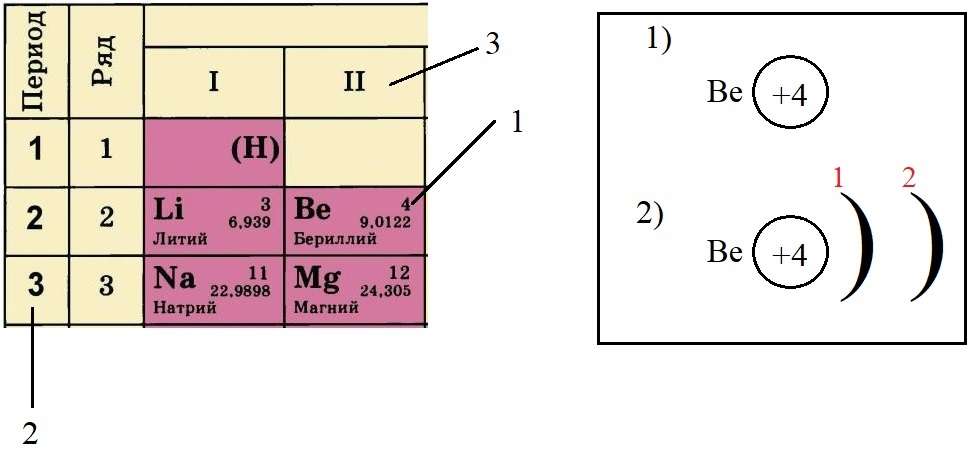
Определяем количество электронов на внешнем уровне, оно равно номеру группы. Бериллий стоит во второй группе, у него два электрона на внешнем слое:
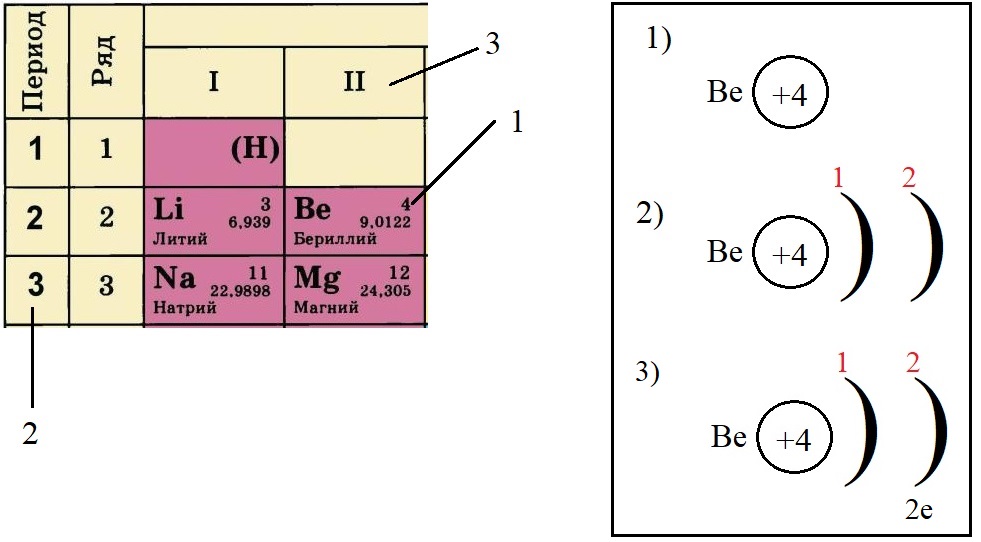
Не трудно догадаться, что если всего у бериллия должно быть четыре электрона, два из которых находятся на внешнем слое, то оставшиеся два находятся на внутреннем слое:
Максимальное количество электронов на уровнях
Чтобы строить электронные конфигурации более крупных атомов, необходимо ввести еще несколько данных. Начнем с максимального количества электронов на определенном уровне, это количество показано на рисунке:

Стоит помнить, что это лишь максимальное количество, большинство элементов не имеют на каждом уровне такого количества электронов.
Так же следует помнить, что какой бы номер не имел бы внешний уровень, на нем максимальное количество электронов не должно превышать восьми.
Следует учитывать, что предвнешний слой следует заполнять последним, чтобы избежать ошибок.
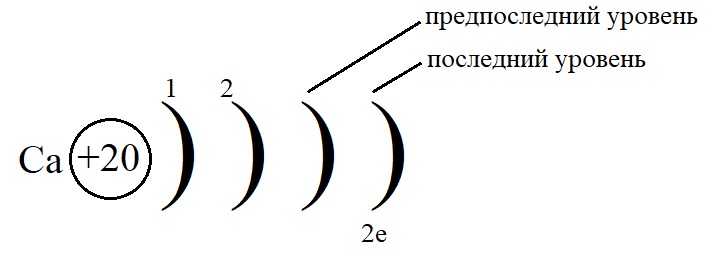
Рассмотрим данные правила на примере построения конфигурации атома кальция.
Порядковый номер кальция – 20, у него 20 протонов в ядре и 20 электронов на орбиталях. Кальций стоит во второй группе, значит, на внешнем слое у него 2 электрона.
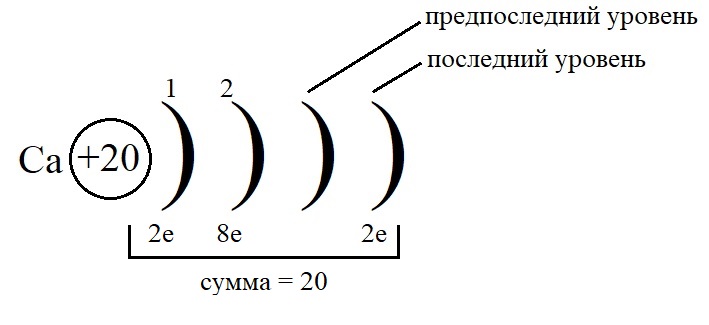
Остальные уровни, кроме предвнешнего, заполняем по максимальному количеству на этих слоях:
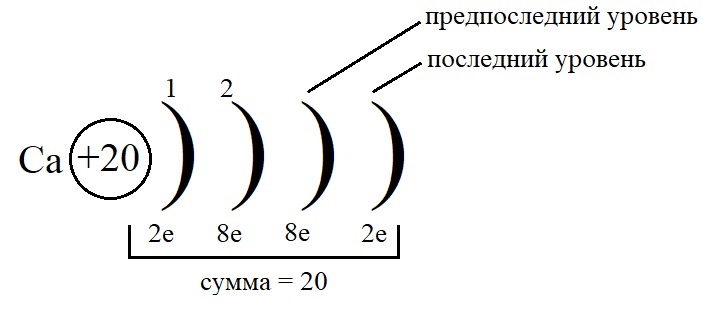
Как показано на рисунке, общее количество электронов должно быть равным двадцати, а пока мы распределили только двенадцать, значит, на предпоследнем уровне необходимо поставить восемь электронов:
Каждый энергетический уровень можно разбить на подуровни (орбитали). Их существует 4 вида: s-, p-, d-, f-орбитали. Они характеризуют область пространства, в которой электрон находится с наибольшей вероятностью.

 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна  Крылова Елизавета Владимировна
Крылова Елизавета Владимировна 
 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна