Значение коэффициентов в уравнении
Коэффициенты показывают отношение количества молекул.
Уравнение можно расценивать, как рецепт. Например, уравнение:
Ca3P2 + 6HCl → 3CaCl2 + 2PH3
Можно воспринимать следующим образом: «Возьмите 1 молекулу фосфида кальция и добавьте к ней 6 молекул соляной кислоты, у вас получится 3 молекулы хлорида кальция и 2 молекулы фосфина». Естественно, в молекулах считать очень неудобно, вместо этого расчеты ведутся по количеству веществ.
Соотношение количеств веществ и количества молекул одинаково! Поэтому, уравнение можно описать следующим образом: «Возьмите 1 моль фосфида кальция и 6 моль хлороводорода, получите 3 моль хлорида кальция и 2 моль фосфина».
Количество вещества в химии – базовое понятие, единица, которая может связать множество других. Его можно найти следующим образом:
Нахождение количества вещества по массе, объёму, количеству частиц
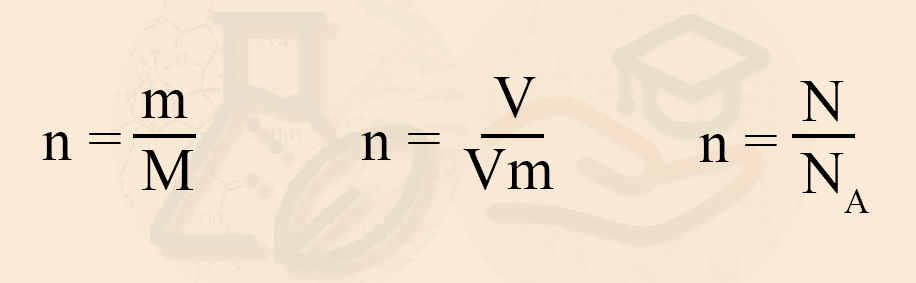
Зная массу или объём, можно определить количество вещества, ввести одно через другое, посчитать количество молекул, атомов и так далее.
Нахождение количества вещества по массе, объёму, количеству частицРешение задачи
Для примера мы решим несколько задач. Рассмотрим методы работы с коэффициентами в уравнении.
Для начала вам следует запомнить, что чтобы пользоваться уравнением химической реакции для расчетов, нужно массу или объём перевести в моль, так как уравнение дает нам понимание соотношений именно по количеству вещества.
Если вы не имеете опыта в решении задач, то сначала лучше подчеркивайте в уравнении известное и искомое, пользуйтесь приведенным ниже алгоритмом.
Алгоритм решения простейших задач по УХР
1) Переведите массу/объём/количество частиц, данных в условии задачи, в количество вещества (n);
2) Определите соотношение известного и искомого вещества по уравнению (сравните коэффициенты), выведите теоретическое количество вещества, искомого по известному;
3) Найдите массу/объём/количество частиц искомого.
Задача 1
Вычислите объём фосфина, образованного из 36,4 г фосфида кальция.
Ca3P2 + 6HCl → 3CaCl2 + 2PH3
Дано:
m(Ca3P2) = 36,4 г
Найти:
V(PH3) = ?
Решение:
Ca3P2 + 6HCl → 3CaCl2 + 2PH3
1) Найдем количество вещества по известной массе фосфида кальция, для этого нам понадобится формула n = m/M. Напоминаем, что M – молярная масса, она численно равна сумме относительных атомных масс, взятых из таблицы Менделеева. Расчет молярной массы всегда производится на ОДНУ молекулу с учетом индексов!
Так, молярная масса фосфида кальция равна
M(Ca3P2) = 40 г/моль ∙ 3 + 31 г/моль ∙ 2 = 182 г/моль (где 3 и 2 – индексы из формулы).
n(Ca3P2) = 36,4 г : 182 г/моль = 0,2 моль.
2) По соотношению в уравнении найдем количество вещества искомого (фосфина) по известному (фосфид кальция). Для этого сравним коэффициенты. Перед фосфином стоит «2», а перед фосфидом кальция «1». Это значит, что по уравнению количество фосфина в два раза больше, чем количество фосфида кальция, следовательно, чтобы найти количество фосфина, нужно количество фосфида кальция умножить на 2.
n(PH3) = 2 ∙ n(Ca3P2) = 2 ∙ 0,2 моль = 0,4 моль.
3) По количеству вещества найдем объём, используя формулу V = n∙Vm, где Vm = 22,4 л/моль – постоянное значение при нормальных условиях.
V(PH3) = 0,4 моль ∙ 22,4 л/моль = 8,96 л.
Задача 2
Определите массу кислорода, затраченного на сжигание 12 г пирита.
4FeS2 + 11O2 → 8SO2 + 2Fe2O3
Дано:
m(FeS2) = 12 г
Найти:
m(O2) = ?
Решение:
4FeS2 + 11O2 → 8SO2 + 2Fe2O3
1) n(FeS2) = 12 г : 120 г/моль = 0,1 моль;
2) Когда коэффициенты перед искомым и известным не имеют общего кратного, можно поступать следующим образом:
- Определить «цену» коэффициента, равного 1. Мы знаем, что в уравнении перед FeS2 стоит 4, это, судя по нашим расчетам, соответствует 0,1 моль.
- Если оба числа разделить на 4 (чтобы коэффициент превратить в единицу), мы узнаем, что коэффициент 1 соответствует 0,025 моль.
- Кислород содержит 11 таких единиц, следовательно
n(O2) = 0,025 моль ∙ 11 = 0,275 моль.

 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна  Крылова Елизавета Владимировна
Крылова Елизавета Владимировна 
 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна