В прошлом учебном году (22/23) на ЕГЭ попалась задача на массовые соотношения трех веществ. Сама по себе задача не очень сложная, но, как и многие другие задачи по неорганической химии, смогла ввести в ступор большинство сдающих. На данный момент она есть в открытом доступе на сайте ФИПИ, без решения и ответа.
Условие задачи
Смешали воду, дигидрофосфат натрия и гидроксид натрия в массовом соотношении 4,5 : 0,9 : 1 соответственно. К образовавшемуся раствору добавили раствор нитрата серебра. При этом получили 442 г раствора, содержащего только одно растворённое вещество, массовая доля которого составила 25%. Определите массовую долю нитрата серебра в добавленном растворе.
Решение задачи с пояснением
- Определим, взято ли какое-то из исходных веществ в избытке.
Для этого посмотрим на условие задачи: дигидрофосфат и гидроксид натрия взяты в массовом соотношении 0,9 к 1. Вода является средой реакции в данном случае, поэтому на первом этапе решения задачи её массу не учитываем.
Зачем определять избыток и недостаток? Во-первых, для дигидрофосфата натрия и гидроксида натрия возможны две реакции. Какая из них произойдет, как раз зависит от того, в каких соотношениях даны исходные вещества:
- NaH2PO4 + NaOH = Na2HPO4 + H2O
- NaH2PO4 + 2NaOH = Na3PO4 + 2H2O
Как видно из данных реакций, если соотношение количеств веществ соли и щелочи будет 1:1, то образуется гидрофосфат натрия, а если щелочи будет в два раза больше, чем соли, то образуется фосфат натрия.
Во-вторых, от того, взято ли какое-то вещество в избытке, будет зависеть дальнейшее решение задачи. И хоть в условии задачи нам непрозрачно намекают, что после добавления нитрата серебра в растворе остается только одно вещество (нетрудно догадаться, что это нитрат натрия), без расчетов данный факт нам мало чем поможет.
Допустим, для реакции взяли х моль NaH2PO4 и y моль NaOH:
n(NaH2PO4) = x моль
m(NaH2PO4) = 120x г
n(NaOH) = y моль
m(NaOH) = 40y моль
Из условия задания: m(NaH2PO4) : m(NaOH) = 0,9 : 1
Или 120x : 40y = 0,9 : 1 или х : y = 1 : 3,33
Таким образом, количество гидроксида натрия (взято за y) в 3,33 раза больше, чем количество дигидрофосфата, следовательно, в растворе произойдет реакция (2), записанная ранее:
NaH2PO4 + 2NaOH = Na3PO4 + 2H2O
Напомню, что в данном уравнении количество вещества гидроксида натрия в два раза больше, чем дигидрофосфата, а по условию количество гидроксида натрия в 3,33 раза больше взятой соли, из чего мы можем сделать вывод, что часть гидроксида натрия не затратится на первый процесс, а при добавлении нитрата серебра произойдет две реакции:
- Na3PO4 + 3AgNO3 = 3NaNO3 + Ag3PO4↓
- 2NaOH + 2AgNO3 = 2NaNO3 + Ag2O↓ + H2O
Данные реакции отвечают условию о том, что в растворе останется только одно растворенное вещество, в нашем случае это нитрат натрия. Также, из этого условия мы можем понять, что в этих реакциях все вещества взяты в правильных пропорциях, нет избытка и недостатка.
- Вернемся к тому, что является целью решения данной задачи, а именно, к определению массовой доли нитрата серебра в добавленном растворе.
Для того чтобы определить массовую долю вещества в растворе, мы должны узнать массу самого раствора и массу растворенного нитрата серебра. На данном этапе о добавленном растворе нитрата серебра неизвестно ничего, кроме того что он дан в «правильном» отношении к реагирующим веществам из первого раствора.
Свяжем то, что известно, с тем, что нужно найти.
По условию задачи образовался раствор массой 442 г, с массовой долей растворенного вещества (нитрата натрия) 25%.
m(NaNO3)чист. = 442 г × 0,25 = 110,5 г
n(NaNO3) = 110,5 г : 85 г/моль = 1,3 моль
Таким образом, после добавления нитрата серебра образовался раствор, в котором количество нитрата натрия составило 1,3 моль.
Общее количество вещества нитрата натрия
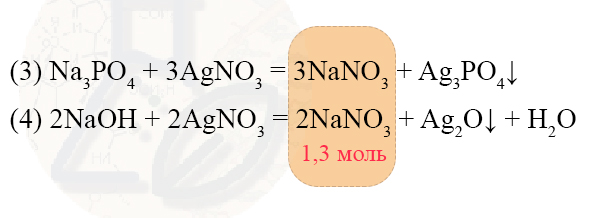
Эти реакции можно связать с исходной, для этого вспомним, что за количество вещества дигидрофосфата натрия мы взяли х моль, а за количество вещества гидроксида натрия y моль.
n(NaH2PO4) = x моль
n(NaOH)исх. = y моль
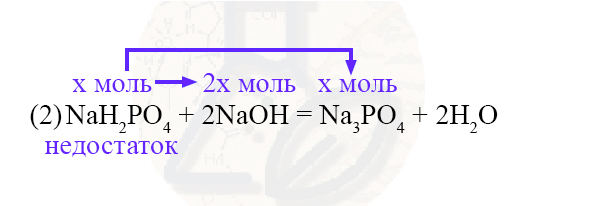
Ранее мы выяснили, что гидроксид натрия дан в избытке, следовательно, дигидрофосфат натрия – в недостатке. Считаем всё по недостатку.
n(NaOH)потрачено = 2n(NaH2PO4) = 2х моль
Всего было y моль NaOH, затратили 2х моль, следовательно:
n(NaOH)избытка = y – 2x
n(Na3PO4) = n(NaH2PO4) = x моль
Переведем эти данные во второй раствор:
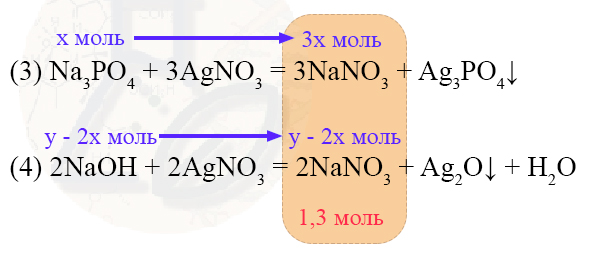
У нас получается уравнение 3х + y – 2x = 1,3 или х + y = 1,3 или y = 1,3 – х (выражение 1)
Также, вспомним выражение, использованное в первом пункте решения задачи: 120x : 40y = 0,9 : 1 (выражение 2)
Подставим выражение 1 в выражение 2:

y = 1,3 – х
у = 1,3 – 0,3
у = 1
Отсюда следует, что
n(NaH2PO4) = 0,3 моль
n(NaOH)исх. = 1 моль
m(NaH2PO4) = 0,3 моль × 120 г/моль = 36 г
m(NaOH)исх. = 1 моль × 40 г/моль = 40 г
по условию задачи, масса воды должна быть в 4,5 раза больше массы гидроксида натрия (читаем условие: смешали воду, дигидрофосфат натрия и гидроксид натрия в массовом соотношении 4,5 : 0,9 : 1 соответственно)
m(H2O) = 4,5 × 40 г = 180 г
Так как при взаимодействии воды, дигидрофосфата натрия и гидроксида натрия не образуются газы и осадки, можем посчитать массу первого раствора:
m(р-ра)1 = 180 + 36 + 40 = 256 г.
В этом растворе находилось 0,3 моль Na3PO4 и 0,4 моль NaOH.
Откуда взялись эти данные? Вспоминаем первую реакцию, в которой дигидрофосфат оказался в недостатке (0,3 моль), на него затрачивается гидроксид натрия 0,6 моль:
n(NaH2PO4) = 0,3 моль
n(NaOH)затрачено. = 2n(NaH2PO4) = 0,6 моль
n(NaOH)исх. = 1 моль
n(NaOH)избыток = 1 моль – 0,6 моль = 0,4 моль
- Проанализируем растворы в этой задаче:
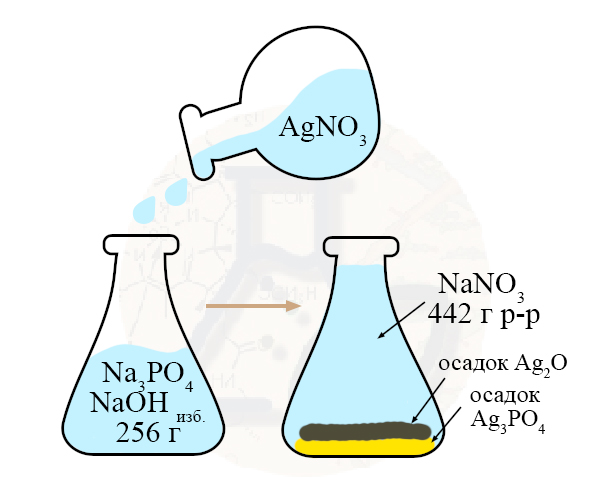
Найдем массу осадков во втором растворе:
n(Ag2O) = 1/2 n(NaOH) = 0,2 моль
n(Ag3PO4) = n(Na3PO4) = 0,3 моль
n(Ag2O) = 0,2 моль × 232 г/моль = 46,4 г
n(Ag3PO4) = 0,3 моль × 419 г/моль = 125,7 г
Сумма веществ в колбе после добавления нитрата серебра 125,7 г + 46,4 г + 442 г = 614,1 г
Таким образом, если к 256 г раствора, содержащего фосфат натрия и гидроксид натрия, прибавить раствор нитрата серебра, то образуются вещества общей суммой 614,1 г, следовательно:
m(AgNO3)р-ра = 614,1 г – 256 г = 358,1 г.
- Найдем массу нитрата серебра и его массовую долю в добавленном растворе.
n(AgNO3) = 3n(Na3PO4) + n(NaOH) = 1,3 моль
m(AgNO3) = 1,3 моль × 170 г/моль = 221 г
ɷ(AgNO3) = 221 г : 358,1 г = 0,617 или 61,7%
ответ: 61,7%

 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна  Крылова Елизавета Владимировна
Крылова Елизавета Владимировна 
 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна