- Основные характеристики циклоалканов:
- Номенклатура циклоалканов
- Малые и обычные циклоалканы
- Строение молекул циклоалканов
- Изомерия циклоалканов
- Химические свойства циклоалканов
- Таблица - Сравнение химических свойств циклоалканов с другими углеводородами
- Получение циклоалканов
- Физические свойства циклоалканов
Циклоалканы – это углеводороды, в которых атомы углерода образуют кольца (иными словами, циклы) и не имеют кратных связей. Циклоалканы в разных учебниках могут называться по-разному: алициклическими соединениями, алифатическими циклами, циклопарафинами, нафтенами (так как содержатся в нефти).
Если Вы уже знакомы с данной темой, попробуйте решить задание:
Задание в формате ЕГЭ с ответом:
Выберите три верных утверждения о свойствах и строении циклоалканов.
- В циклоалканах на одну свесь С-С больше, чем в алканах с таким же количеством углерода
- Цис- и трансизомеры легко превращаются друг в друга
- Малые циклоалканы менее устойчивы, чем нормальные
- Межклассовыми изомерами циклоалканов являются циклоалкены
- Для циклоалканов характерна sp3-гибридизация
- Циклопентан относят к малым циклам
Вернитесь к заданию после прочтения материала, если Вы пока не понимаете, о чём речь.
Основные характеристики циклоалканов:
- Предельные (не имеют кратных связей)
- Атомы находятся в sp3-гибридицазии
- Только σ-связи (однако есть так называемые «банановые», грубо говоря, это деформированные σ-связи)
- Общая формула циклоалканов CnH2n
Номенклатура циклоалканов
Называются циклоалканы подобно алканам, только с приставкой «цикло». Если трехуглеродный алкан называют пропаном, то трехуглеродный цикл – циклопропаном.
Как изобразить циклоалкан?
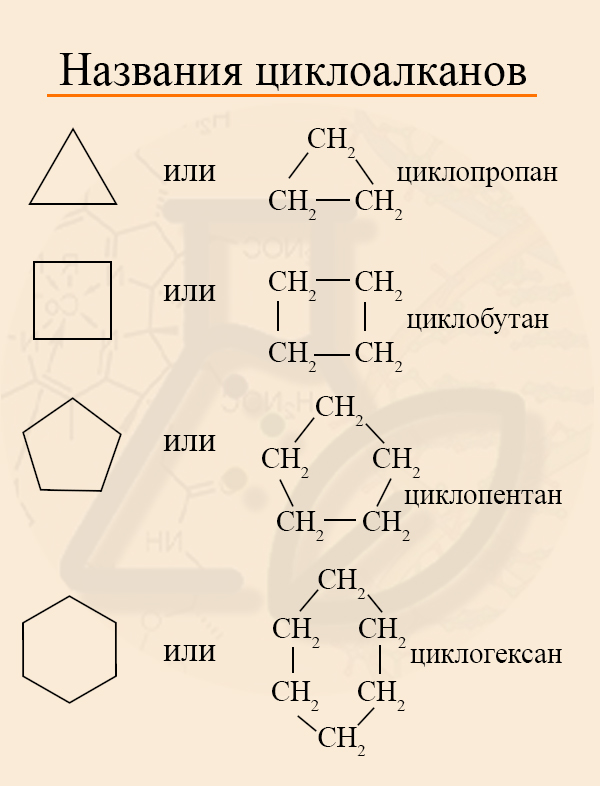
Если в кольце есть один заместитель, то его называют, не указывая номер углерода, так как в этом нет смысла. Номенклатура радикалов такая же, как в алканах, название основного вещества и радикала пишут слитно:
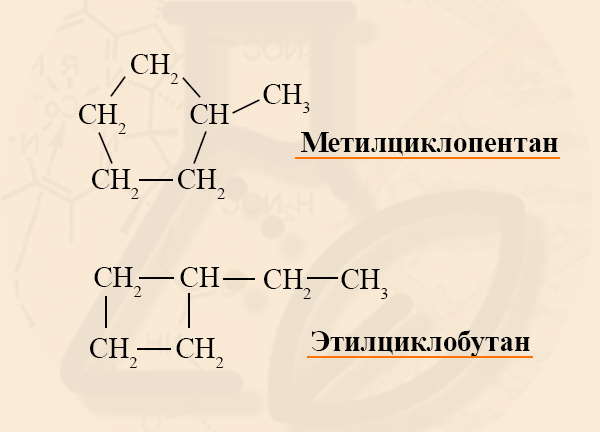
Если в кольце два или более заместителя, то при составлении названия пользуются следующими правилами:
- Нумерацию углеродов кольца производят таким образом, чтобы заместители получили наименьшие номера.
- Одинаковые радикалы называют с приставкой «ди-», «три-» и так далее, как это было в номенклатуре алканов.
- Заканчивают номенклатуру названием цикла:
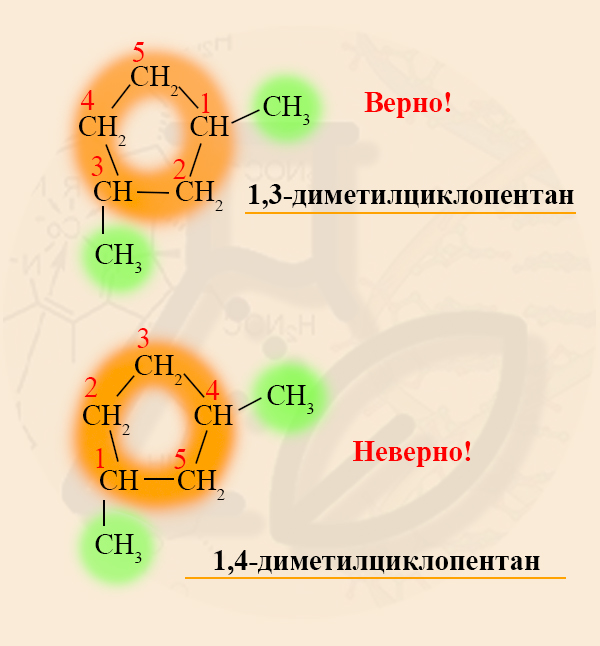
Разноименные радикалы называют в порядке алфавита, то есть, если в кольце есть заместитель CH3 – Метил и CH3-CH2 – Этил, то первый номер обязательно займет метил, так как буква «М» стоит в алфавите раньше, чем «Э».
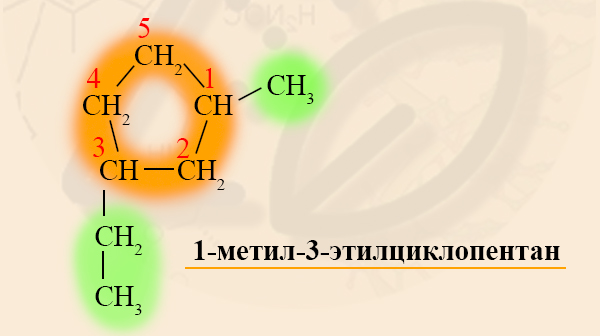
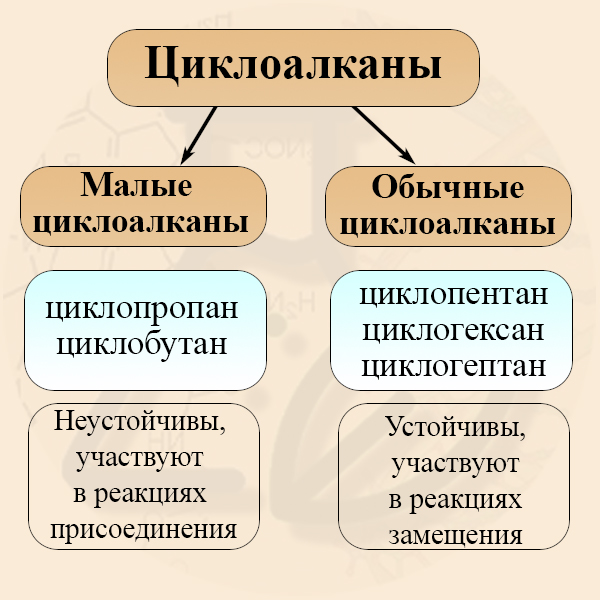
Малые и обычные циклоалканы
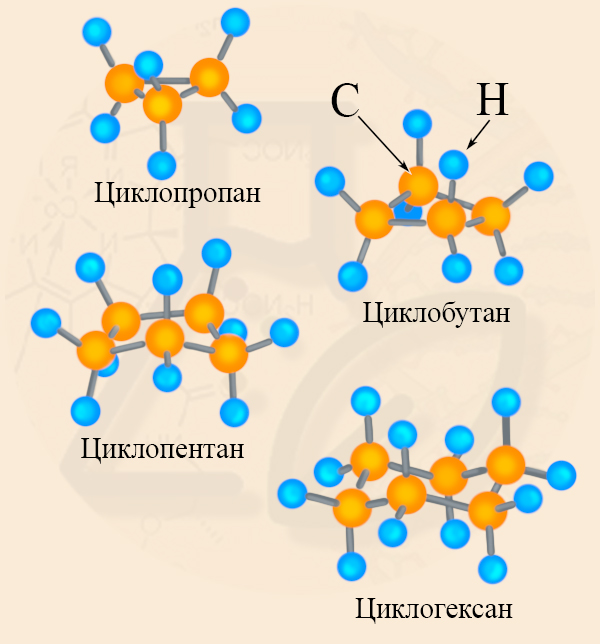
По размеру кольца циклоалканы принято разделять на малые и нормальные циклы (также встречается деление циклоалканов на малые, средние и большие, но такой способ их классификации встречается реже). К малым циклоалканам относят циклопропан и циклобутан, к обычным или средним циклам относят циклопентан, циклогексан и циклогептан. Малые и обычные циклы значительно отличаются друг от друга по ряду химических свойств:
Чтобы понять, в чем причина таких значительных отличий внутри одной гомологической группы, следует разобрать строение циклоалканов.
Строение молекул циклоалканов
- Строение молекулы циклопропана
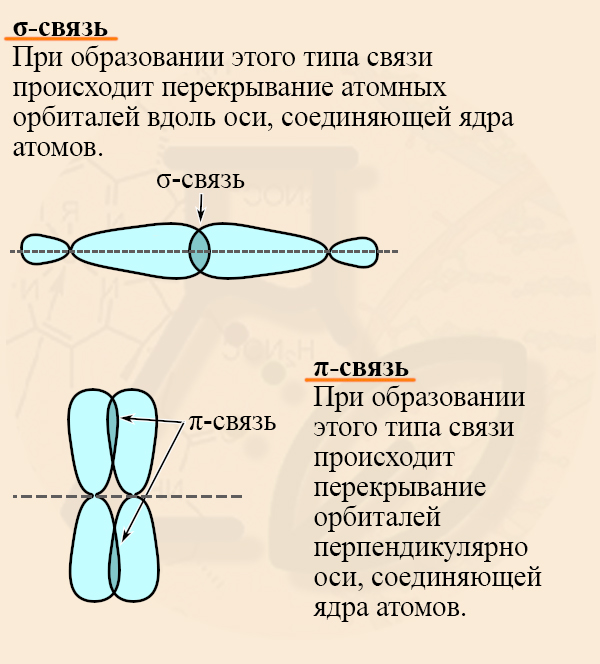
Для начала следует вспомнить особенности σ- (сигма) и π-связей (пи-связей). Для веществ с простыми (ПРЕДЕЛЬНЫМИ) связями характерна sp3-гибридизация (то есть все четыре орбитали – 1s и 3p гибридизуются, усредняются), а между атомами углерода образуются σ- связи. При образовании этого типа связи происходит перекрывание атомных орбиталей вдоль оси, соединяющей ядра атомов.
У непредельных (имеющих двойные или тройные связи) веществ гибридизованы не все орбитали, и между негибридизованными может образовываться π-связь. При образовании этого типа связи происходит перекрывание орбиталей перпендикулярно оси, соединяющей ядра атомов.
К чему же мы упоминаем π-связь, когда в циклоалканах нет непредельных связей?
Для sp3-гибридизации характерен угол связи равный 109,5º, но как расположить три углерода в цикле, чтобы такой угол сохранился (Вы ведь помните, что у равностороннего треугольника углы равны 60º)? К сожалению, никак! Чтобы трехуглеродная молекула образовала кольцо (треугольник), углы связей придется сжать, при этом возникает угловая напряженность связи.
Скажем простыми словами: 4 электрона (ведь столько неспаренных электронов содержится у атома углерода в возбужденном состоянии, что и определяет валентность IV атома углерода в органических соединениях) способны «терпеть» друг друга, если их орбитали расположены максимально удаленно друг от друга. Такое удаление обеспечивается расположением четырех гибридных орбиталей в форме тетраэдра, угол между орбиталями в нем составляет 109,5º. Такое мы наблюдаем в алканах.
Вернемся же к малым циклоалканам. Чтобы замкнулось кольцо, две из четырех орбиталей должны находиться под меньшим углом друг к другу, из-за чего стремятся «разжаться» и прийти снова в более комфортное состояние тетраэдра, поэтому малые циклы участвуют в реакциях присоединения, при которых цикл разрывается и орбитали углеродов встают в свое наиболее устойчивое положение.
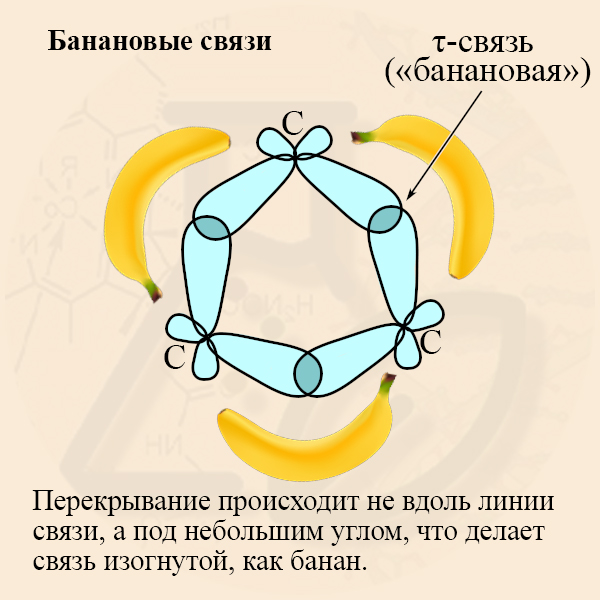
Хотелось бы добавить, что гибридизованные орбитали углеродов в малых циклах перекрываются не как обычно – по линии, когда образуется σ-связь, перекрытие получается полубоковым. Такая связь получила название τ-связи или «банановой» связи (на рисунке изображены только С – С связи, участвующие в образовании кольца):
Обобщим:
- σ – связь является прочной, если молекула имеет только такой тип связей, то для нее характерны реакции замещения.
- π – менее прочная, наличие такой связи в молекуле обеспечивает возможность осуществления реакций присоединения.
- τ-связь (тау-связь) – является промежуточной, она менее прочна, чем σ-связь, поэтому для малых циклов характерны реакции присоединения.
- Строение циклобутана
Чем больше углов в фигуре, тем больше может быть угол связи, кроме того, четырехуглеродное кольцо может быть не плоским, что также позволяет снять «напряженность» связей. Для циклобутана тоже характерны реакции присоединения, но идут они гораздо труднее, чем у циклопропана (то есть циклобутан устойчивее своего трехуглеродного гомолога).
За счет неплоской структуры циклопентану и циклогексану удается избежать углового напряжения, поэтому они более стабильны:
Изомерия циклоалканов
- Структурная изомерия циклоалканов
Этот тип изомерии связан положением заместителей или размером цикла. Помните, что изомерами называют вещества с одинаковым составом (одинаковой брутто-формулой), но разным строением:
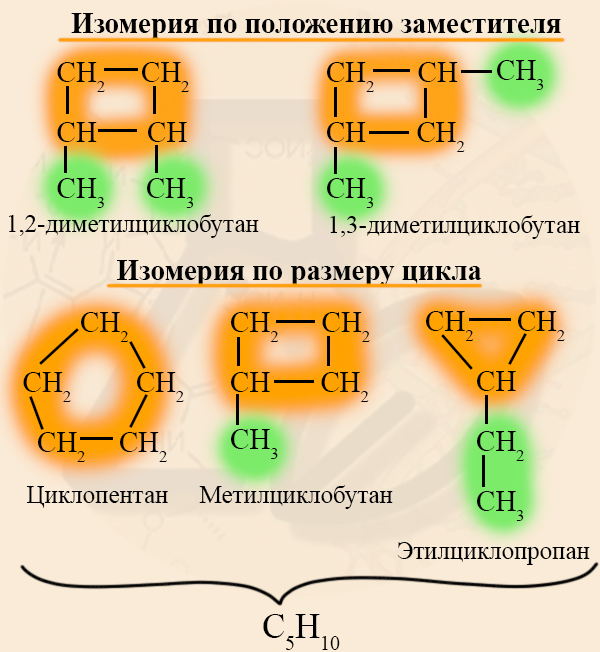
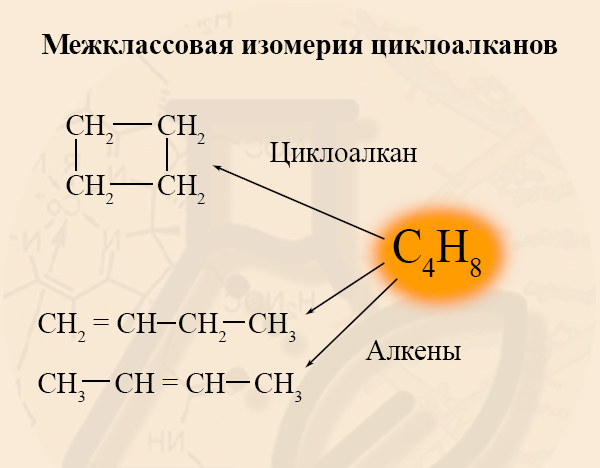
- Межклассовая изомерия циклоалканов
Межклассовыми изомерами циклоалканов являются алкены. У этих двух групп одинаковая общая формула CnH2n. Так как общая формула у этих двух классов равна, Вы смело можете говорить, что циклоалкан и алкен являются изомерами, если они содержат одинаковое количество углерода.
- Пространственная геометрическая изомерия (цис-транс-изомерия)
Цис- и трансизомерия – это возможность существования двух, казалось бы, совершенно одинаковых веществ в двух формах, отличающихся по некоторым физическим или даже химическим свойствам. Рассмотрим, к примеру, цис-1,2-диметилциклопропан и транс-1,2-диметилциклопропан. Если одинаковые заместители находятся либо только сверху плоскости связи, либо только снизу, то такой изомер называют «цис-…», если одинаковые заместители находятся по разные стороны от плоскости связи, то такой изомер называют «транс-…».
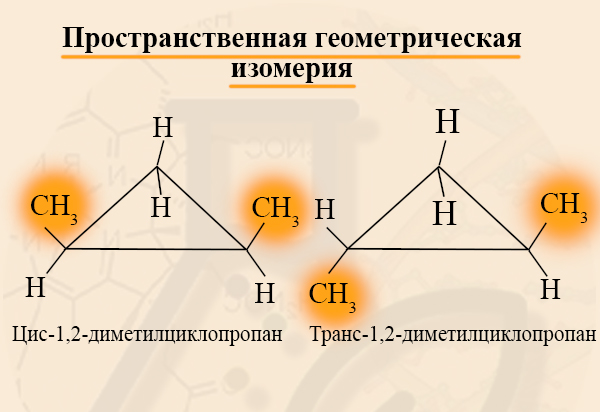
Для каких циклоалканов характерна цис-трансизомерия? Для тех, которые содержат два заместителя на РАЗНЫХ атомах углерода кольца. При этом, стоит отметить, что цис- и трансизомеры не могут переходить друг в друга, их стоит рассматривать, как две совершенно разные молекулы.
Пример задания из КИМ ЕГЭ:
Выберите все вещества, являющиеся изомерами циклопентана:
1) циклобутан; 2) метилциклобутан; 3) этилциклопропан; 4) метилциклопропан; 5) 2-метилбутен-2. Запишите в графу ответов последовательность цифр в порядке возрастания.
Химические свойства циклоалканов
Химические свойства малых и средних (обычных) циклов в значительной степени отличаются. О причинах этого написано выше.
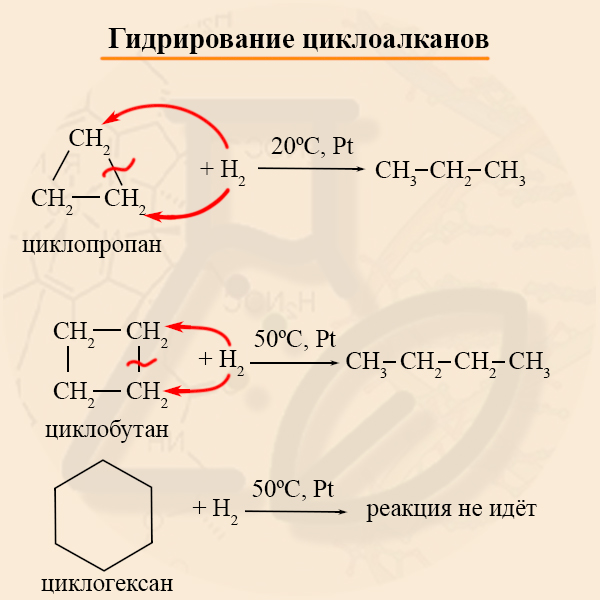
- Гидрирование циклоалканов
В реакцию с водородом вступают преимущественно малые циклы, реакцию проводят на никелевом или платиновом катализаторе. На примере гидрирования хорошо заметно увеличение устойчивости циклов с ростом кольца.
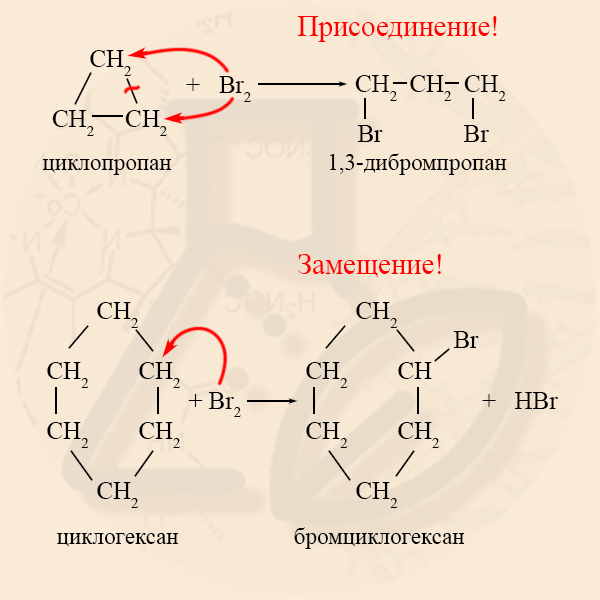
- Галогенирование циклоалканов
Реакции галогенирования характерны как для малых циклов, так и для нормальных, но в механизме реакций есть существенные отличия: малые циклы вступают с галогенами в реакции ПРИСОЕДИНЕНИЯ, а нормальные – в реакции ЗАМЕЩЕНИЯ.
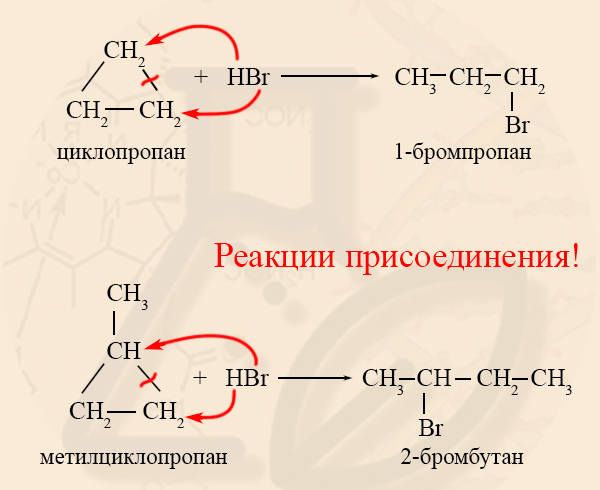
- Гидрогалогенирование циклоалканов
Гидрогалогенирование возможно только для малых циклов, причем, если циклоалкан содержит заместитель, то реакция идет по правилу Марковникова.
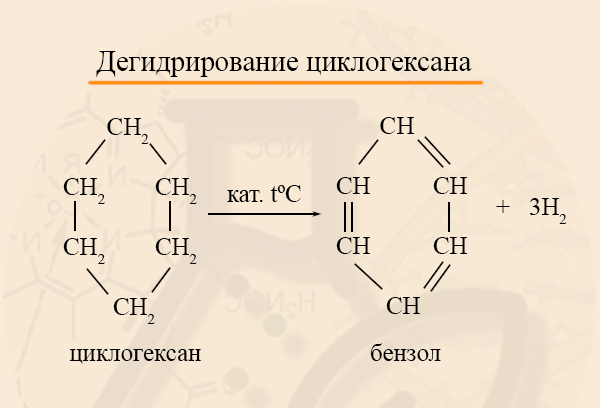
- Дегидрирование циклоалканов
При дегидрировании циклогексана и других его гомологов с шестью атомами углерода в кольце, образуются арены.
Задание по образцу ФИПИ:
Выберите все вещества, с которыми может реагировать циклопентан:
1) водород; 2) кислород; 3) азот; 4) хлор на свету; 5) бромоводород.
Запишите в графу ответов последовательность цифр в порядке возрастания.
Таблица - Сравнение химических свойств циклоалканов с другими углеводородами
Интересно рассмотреть циклоалканы в сравнении с алканами и алкенами
|
Реагент |
Алкан |
Малый цикл |
Нормальный цикл |
Алкен |
|
Водород |
Реакция не идет |
Присоединение с образованием алкана |
Реакция не идет |
Присоединение с образованием алкана |
|
Хлор/бром |
Реакция замещения, образуется моногалогеналкан |
Реакция присоединения, образуется дигалогеналкан |
Реакция замещения с сохранением цикла |
Реакция присоединения с образованием дигалогеналкана |
|
Хлороводород/ бромоводород |
Реакция не идет |
Реакция присоединения |
Реакция не идет |
Реакция присоединения |
Из таблицы видно, что малые циклы больше похожи на алкены, а нормальные циклы – на алканы.
Попробуйте решить задание ЕГЭ:
Выберите три верных ответа из шести. Для циклогексана, в отличие от циклопропана, характерно:
- С галогенами вступает в реакции замещения
- Реагирует с водой
- Атомы углерода, принадлежащие циклу, не образуют плоскую фигуру
- Окисляется при горении на воздухе
- Не реагирует с бромоводородом
- Реагирует с метаном
Получение циклоалканов
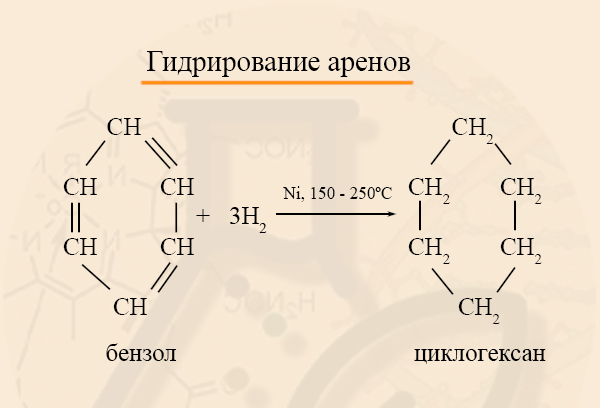
- Получение циклоалканов из аренов
Из бензола и его гомологов можно получить циклогексан и его гомологи:
- Получение циклоалканов из циклоалкенов
Аналогично предыдущему методу получения, исходное вещество гидрируется:
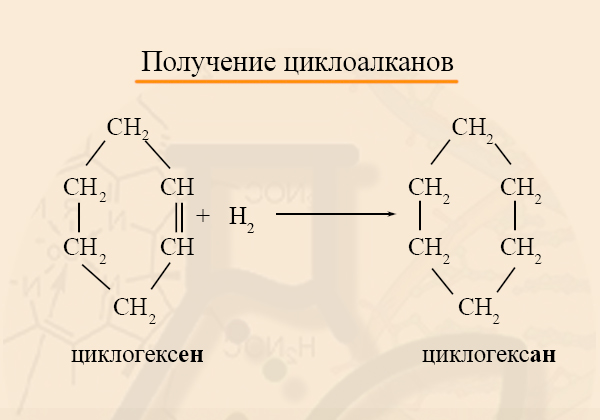
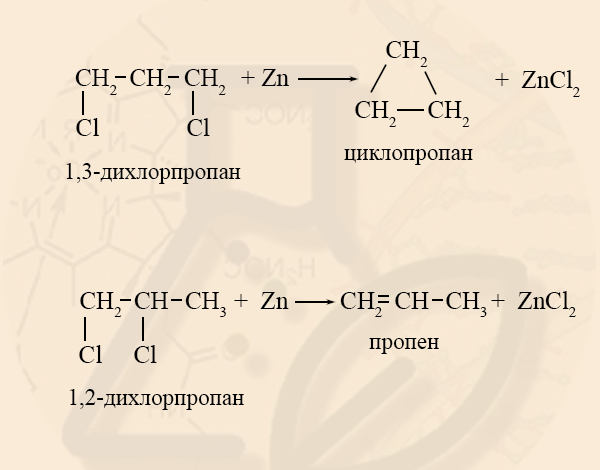
- Получение циклоалканов из дигалогеналканов
Условием образования циклоалкана из дигалогеналкана является то, что галогены должны находиться хотя бы через 1 атом углерода. Если вещество имеет заместитель на соседних атомах углерода, то образуется не циклоалкан, а алкен:
Выберите все вещества, из которых можно получить циклобутан напрямую (одной реакцией):
1) бутен-2; 2) 1,2-дибромбутан; 3) циклобутен; 4) 1,4-дихлорбутан; 5) хлорэтан. Запишите в графу ответов последовательность цифр в порядке возрастания.
Физические свойства циклоалканов
- Физические свойства циклоалканов близки к таковым у соответствующих алканов, несколько отличаются температура кипения и плотность (у циклоалканов она выше).
- Циклоалканы нерастворимы в воде (циклоалканы неполярные, а вода – полярный растворитель).
- Но циклоалканы растворимы в эфирах и четыреххлористом углероде (это неполярные растворители, неполярное хорошо растворяется в неполярном).

 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна  Крылова Елизавета Владимировна
Крылова Елизавета Владимировна 
 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна