Есть в таблице Д. И. Менделеева группа элементов, именуемая благородным или инертными газами. Названы они так не спроста, хоть они и проявляют окислительно-восстановительные свойства и вступают в химическую связь, их соединений мы знаем не так много, как соединений многих других элементов. Их низкую химическую активность объясняет то, что у этих элементов «идеальное» количество электронов – восемь (исключение – гелий, однако у него внешний энергетический уровень так же является завершенным, так как на первом уровне может разместиться только два электрона, а не восемь). Атомы с таким количеством электронов на внешнем энергетическом уровне устойчивы и не стремятся к химическому взаимодействию. Максимальное количество электронов на внешнем уровне равно восьми, легко запомнить, так как групп в классической периодической системе восемь, а именно группа определяет количество электронов на внешнем энергетическом уровне.
Остальные элементы стремятся принять конфигурацию благородного газа, превращаясь при этом в ионы.
Рассмотрим данный процесс на примере некоторых элементов.
Конфигурация благородного газа. Образование ионной связи.
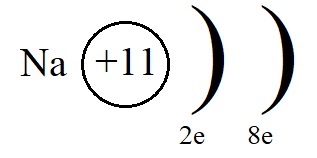
 Строение атома натрия
Строение атома натрия
Атому натрия, для завершения внешнего энергетического уровня не хватает семь электронов, притянуть такое количество, имея большой радиус и небольшое количество протонов оказывается невозможным. Поэтому натрию легче отдать электрон внешнего уровня, тогда второй уровень станет внешним, на нём как раз расположено восемь электронов.
Однако, при этом количество протонов в ядре остаётся равным одиннадцати, а электронов теперь всего десять. Элементарные вычисления (+11-10 = +1) дают нам понять, что теперь это не атом, а положительно заряженная частица – ион:
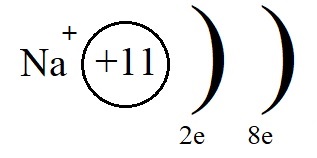
Ионы, несущие положительный заряд, называются катионами.
Если же мы рассмотрим строение внешнего энергетического уровня фтора, то обнаружим, что этому элементу до завершенного внешнего уровня не хватает всего одного электрона:
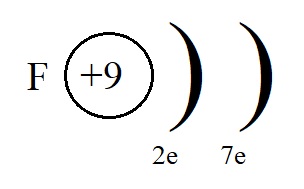
Этот электрон фтор может получить от натрия, превратившись при этом в отрицательно заряженную частицу – анион:
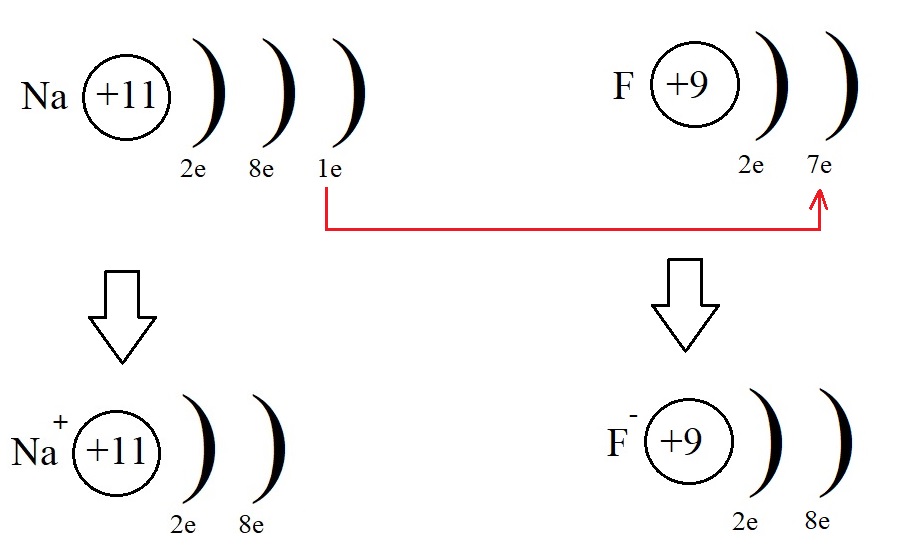
Оба атома при таком взаимодействии приняли конфигурацию благородного газа (8 электронов на внешнем уровне), превратились в ионы, после чего притянулись друг к другу из-за противоположных знаков и образовали фторид натрия NaF. Так образуется ионная связь.
Элементы, которые с наибольшей вероятностью отдают электроны, называют металлами, у них хорошо выражены восстановительные свойства (способность отдавать свои электроны, восстанавливая электронную оболочку другого атома до восьмиэлектронной).
Элементы, с наибольшей вероятностью «отнимающие» чужие электроны, называют неметаллами, они проявляют окислительные свойства.
Элементы, отдающие электроны (восстановители) повышают свою степень окисления, тогда как элементы, принимающие электроны (окислители) – понижают степень окисления за счет того, что принятые электроны несут отрицательный заряд.
Исходная частица | Структура внешнего энергетического уровня | процесс | Полученная частица | Структура внешнего энергетического уровня |
F0 | 2s22p5 | +1ē | F‒ | 2s22p6 |
Na0 | 3s1 | ‒1ē | Na+ | 3s0 Или 2s22p6, так как предвнешний уровень становится внешним |
Решение типовых заданий №1 ЕГЭ по химии.
Пример 1.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. |
Определите, однозарядные катионы каких из указанных элементов имеют конфигурацию благородного газа.
Решение: хром и кальций не образуют однозарядных катионов, однако, если это еще не известно, лучше построить электронные конфигурации всех предложенных элементов, предположив, что они все могут образовывать однозарядный катион. Однозарядный катион имеет заряд +1, значит, от исходного атома нужно отнять один электрон, получив восемь электронов на внешнем (скорее предвнешнем уровне, поэтому укажем и его):
Исходная частица | Структура внешнего энергетического уровня | процесс | Полученная частица | Структура внешнего энергетического уровня |
Cr | 3d54s1 | ‒1ē | Cr+ | 3d5 |
Ca | 3s23p64s2 | ‒1ē | Ca+ | 3s23p64s1 |
K | 3s23p6 | ‒1ē | K+ | 3s23p6 |
Cu | 3d104s1 | ‒1ē | Cu+ | 3d10 |
Li | 1s22s1 | ‒1ē | Li+ | 1s2 |
Из всех полученных ионов восьмиэлектронный внешний энергетический уровень имеет лишь катион калия. Но это задание типовое, в нём обязательно должно быть два ответа. Вторым верным ответом будет литий, так как он принимает конфигурацию гелия, у которого на внешнем уровне всего два электрона. Знание того, что хром и кальций не образуют однозарядных катионов, просто сэкономит Вам время.
Ответ: 35
Пример 2.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. |
Определите, трехзарядные анионы каких из указанных элементов имеют конфигурацию благородного газа.
Решение: попробуем решить данное задание методом исключения:
Натрий – металл, не проявляет окислительных свойств, не может стать анионом.
Водород может принять только один электрон, так как у него всего один энергетический уровень (водород стоит в первом периоде), на первом уровне может уместиться всего два электрона. Поэтому приняв к уже имеющемуся единственному электрону еще один, водород становится однозарядным анионом.
У хлора на внешнем уровне уже имеется семь электронов, есть место только для одного дополнительного, приняв его, хлор станет однозарядным анионом.
Остаётся азот и мышьяк. У обоих есть три неспаренных p-электрона, которые можно дополнить тремя чужими электронами, образуя трехзарядный анион.
Ответ: 24

 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна  Крылова Елизавета Владимировна
Крылова Елизавета Владимировна 
 Селивёрстова Алиса Андреевна
Селивёрстова Алиса Андреевна